Mengapa dalam menggambar teknik diperlukan standar iso jelaskan – Mengapa Standar ISO Diperlukan dalam Menggambar Teknik? Pertanyaan ini krusial bagi keberhasilan proyek teknik, baik skala kecil maupun besar. Bayangkan sebuah gedung pencakar langit runtuh karena kesalahan interpretasi gambar, atau sebuah mesin canggih gagal beroperasi akibat ambiguitas desain. Kejadian-kejadian seperti ini bukan sekadar mimpi buruk, tetapi risiko nyata yang dapat dicegah. Standar, khususnya standar ISO, berperan sebagai bahasa universal dalam dunia gambar teknik, memastikan keseragaman, kejelasan, dan efisiensi. Penerapannya bukan sekadar formalitas, melainkan kunci keberhasilan proyek dan keselamatan semua pihak yang terlibat.
Konsistensi dan kejelasan adalah fondasi dari setiap proyek teknik yang sukses. Gambar teknik yang standar, yang mengikuti pedoman ISO, memastikan semua pihak – mulai dari perancang, teknisi, hingga kontraktor – memahami informasi dengan cara yang sama. Hal ini meminimalkan risiko kesalahan interpretasi yang dapat berujung pada kerugian finansial, bahkan kecelakaan. Standar ISO menawarkan kerangka kerja yang teruji, memastikan bahwa setiap detail, setiap dimensi, dan setiap simbol terdefinisi dengan jelas, mengurangi ambiguitas dan meningkatkan efisiensi kerja. Dengan demikian, proyek dapat berjalan lancar, tepat waktu, dan sesuai anggaran.
Pentingnya Standar dalam Gambar Teknik
Dalam dunia konstruksi dan manufaktur, gambar teknik bukan sekadar sketsa. Ia merupakan bahasa universal yang menghubungkan ide, perencanaan, dan eksekusi. Ketepatan dan konsistensi dalam gambar teknik, yang diwujudkan melalui penerapan standar ISO, menjadi kunci keberhasilan proyek. Ketidaktepatan ini berdampak signifikan, mulai dari pembengkakan biaya hingga kecelakaan kerja. Mari kita telusuri lebih dalam betapa krusialnya standar ISO dalam ranah gambar teknik.
Konsistensi dan Standar dalam Gambar Teknik
Konsistensi dan standar dalam gambar teknik bukanlah sekadar soal estetika. Lebih dari itu, hal ini merupakan fondasi dari komunikasi yang efektif antar tim proyek. Bayangkan sebuah proyek konstruksi gedung pencakar langit. Jika setiap arsitek, insinyur sipil, dan kontraktor menggunakan standar dan simbol yang berbeda, maka akan terjadi kebingungan dan kesalahan interpretasi yang berujung pada inefisiensi dan potensi kerugian besar. Standar ISO memastikan semua pihak “berbicara” dalam bahasa yang sama, sehingga mengurangi risiko kesalahan dan mempercepat proses pengerjaan.
Dampak Negatif Gambar Teknik Tidak Standar
Penggunaan gambar teknik yang tidak standar berpotensi menimbulkan dampak buruk yang meluas. Mulai dari kesalahan interpretasi gambar, hingga kecelakaan kerja, dan bahkan kerugian finansial yang signifikan. Ketidakjelasan dimensi, simbol yang ambigu, dan kurangnya detail teknis dapat mengakibatkan material terbuang sia-sia, pengerjaan ulang, dan bahkan penundaan proyek. Dalam skala yang lebih besar, hal ini dapat berujung pada tuntutan hukum dan reputasi perusahaan yang tercoreng. Tidak ada yang mau menghadapi situasi seperti ini.
Contoh Kasus Ketidakstandaran Gambar Teknik, Mengapa dalam menggambar teknik diperlukan standar iso jelaskan
Salah satu contoh nyata dampak negatif gambar teknik yang tidak standar adalah kasus pembangunan jembatan di suatu daerah. Akibat ketidakjelasan spesifikasi material pada gambar teknik, kontraktor menggunakan material yang tidak sesuai standar. Hasilnya, jembatan tersebut runtuh sebelum masa operasionalnya, menyebabkan kerugian finansial yang besar dan bahkan korban jiwa. Kasus ini menjadi pengingat betapa pentingnya ketelitian dan konsistensi dalam penerapan standar ISO.
Perbandingan Gambar Teknik Standar dan Tidak Standar
| Aspek | Gambar Standar (ISO) | Gambar Tidak Standar | Dampak |
|---|---|---|---|
| Skala dan Dimensi | Jelas, konsisten, dan sesuai standar | Tidak konsisten, ambigu, dan sulit dipahami | Kesalahan pengukuran, pemborosan material |
| Simbol dan Notasi | Standar dan mudah dipahami | Tidak standar, beragam interpretasi | Kesalahan interpretasi, pengerjaan ulang |
| Detail Teknis | Lengkap dan rinci | Tidak lengkap, kurang detail | Kesalahan konstruksi, kecelakaan kerja |
Ilustrasi Perbedaan Gambar Teknik
Bayangkan dua sketsa sederhana sebuah baut. Gambar standar akan menunjukkan dimensi baut dengan presisi, menggunakan simbol dan notasi yang baku, dan disertai spesifikasi material. Sementara itu, gambar tidak standar akan terlihat acak, dimensi tidak jelas, dan simbol yang digunakan tidak konsisten. Perbedaannya sangat kentara: satu memberikan informasi yang jelas dan terukur, sementara yang lain menimbulkan ambiguitas dan potensi kesalahan.
Standar ISO dalam menggambar teknik penting karena memastikan keseragaman dan kejelasan informasi teknis. Bayangkan jika setiap insinyur menggunakan skala dan notasi berbeda; proyek konstruksi bisa kacau balau, mirip seperti aturan etika berpakaian di sekolah yang memastikan ketertiban dan kenyamanan lingkungan belajar. Konsistensi, seperti halnya dalam berpakaian, krusial untuk menghindari misinterpretasi dan memastikan efisiensi kerja. Dengan standar ISO, ambiguitas minimalisir, menghasilkan desain yang akurat dan terhindar dari kesalahan fatal yang berujung pada kerugian.
Singkatnya, standar ISO dalam menggambar teknik adalah kunci keberhasilan proyek, sama pentingnya dengan pemahaman aturan berpakaian di lingkungan pendidikan.
Peran ISO dalam Standarisasi Gambar Teknik
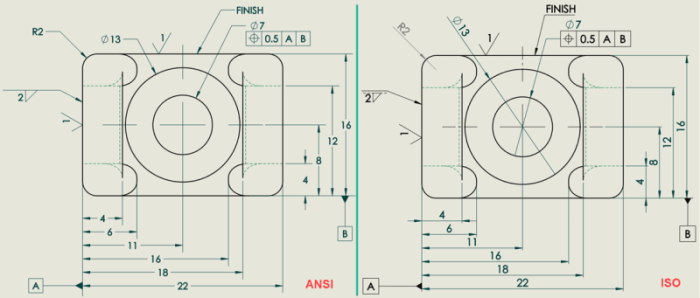
Standarisasi dalam gambar teknik bukan sekadar tren, melainkan fondasi krusial bagi kolaborasi global yang efektif dan efisien. Bayangkan skenario tanpa standar: proyek konstruksi menara pencakar langit ambruk karena kesalahan interpretasi gambar, atau manufaktur pesawat terbang mengalami keterlambatan masif akibat perbedaan ukuran komponen. Itulah mengapa peran organisasi internasional seperti ISO begitu vital.
ISO, singkatan dari International Organization for Standardization, berperan sebagai penentu standar internasional yang diakui secara luas. Standar-standar ini memastikan keseragaman, kejelasan, dan kepastian dalam komunikasi teknis melalui gambar, sehingga meminimalisir ambiguitas dan meningkatkan produktivitas. Dalam dunia gambar teknik, standar ISO merupakan bahasa universal yang dipahami oleh para insinyur, arsitek, dan teknisi di seluruh dunia, memungkinkan proyek-proyek skala besar berjalan lancar tanpa hambatan komunikasi antar negara.
Standar ISO Relevan dalam Gambar Teknik
Beberapa standar ISO yang umum digunakan dalam dunia gambar teknik mencakup aspek-aspek vital, mulai dari presentasi hingga toleransi dimensi. Penerapan standar ini memastikan kualitas, konsistensi, dan interoperabilitas gambar teknik di berbagai industri dan negara.
Standar ISO dalam menggambar teknik, sebagaimana pentingnya pemahaman mendalam nilai-nilai Pancasila, menjamin keseragaman dan kejelasan komunikasi teknis. Bayangkan, jika setiap insinyur menggunakan ukuran dan simbol berbeda; kerancuan fatal bisa terjadi. Hal ini mengingatkan kita pada pentingnya konsistensi, seperti halnya pertanyaan tentang pendidikan Pancasila yang menuntut pemahaman menyeluruh dan konsisten akan nilai-nilai luhur bangsa.
Kembali ke standar ISO, penerapannya memastikan proyek konstruksi, desain mesin, atau gambar teknik lainnya dapat dipahami secara universal, mencegah kesalahan interpretasi yang berpotensi merugikan. Standarisasi ini, sebagaimana pendidikan Pancasila yang ideal, membangun fondasi yang kokoh dan terukur untuk keberhasilan.
- ISO 128-20:2018: Standar ini mendefinisikan prinsip-prinsip umum untuk presentasi gambar teknik, meliputi format, penomoran, dan simbol-simbol yang digunakan. Dengan adanya standar ini, gambar teknik menjadi lebih mudah dibaca dan dipahami secara universal, mengurangi risiko kesalahan interpretasi.
- ISO 1101:2017: Standar ini berkaitan dengan toleransi geometrik produk (Geometric Dimensioning and Tolerancing atau GD&T). GD&T merupakan sistem yang digunakan untuk menspesifikasikan toleransi bentuk, orientasi, lokasi, dan runout komponen. Standar ini memastikan agar komponen-komponen yang diproduksi di berbagai belahan dunia dapat dirakit dengan sempurna.
- ISO 2768:2010: Menentukan toleransi umum untuk dimensi linear dan sudut. Standar ini memberikan acuan toleransi yang dapat diterima secara internasional, memudahkan manufaktur dan mengurangi potensi penolakan komponen karena perbedaan interpretasi toleransi.
Perbandingan Standar ISO dengan Standar Nasional
Meskipun standar ISO diakui secara global, negara-negara juga memiliki standar nasional mereka sendiri dalam gambar teknik. Perbedaan ini dapat muncul karena faktor historis, kebutuhan industri spesifik, atau regulasi lokal. Namun, tujuan utamanya tetap sama: menciptakan keseragaman dan kejelasan dalam komunikasi teknik.
| Aspek | Standar ISO | Standar Nasional (Contoh: Indonesia SNI) |
|---|---|---|
| Format Gambar | Lebih fleksibel, mengikuti prinsip umum | Mungkin lebih spesifik dan terkadang terikat pada regulasi lokal |
| Simbol | Menggunakan simbol-simbol internasional yang telah distandarisasi | Mungkin menggunakan beberapa simbol tambahan atau variasi dari simbol internasional |
| Toleransi | Menawarkan kerangka kerja umum, memungkinkan penyesuaian | Mungkin memiliki spesifikasi lebih detail terkait toleransi dalam konteks industri tertentu di negara tersebut |
| Penerapan | Penerapan global, diakui secara luas | Penerapan terbatas pada wilayah nasional, mungkin kurang dikenal di luar negeri |
Kutipan Standar ISO tentang Pentingnya Standarisasi
“Standarisasi dalam gambar teknik sangat penting untuk memastikan komunikasi yang efektif dan efisien antar berbagai pihak yang terlibat dalam suatu proyek. Hal ini meminimalisir ambiguitas, mengurangi kesalahan, dan meningkatkan produktivitas.” – (Paraphrase dari prinsip umum dalam berbagai standar ISO terkait gambar teknik).
Keuntungan Penggunaan Standar ISO dalam Gambar Teknik
Adopsi standar ISO dalam gambar teknik menawarkan sejumlah keuntungan signifikan, baik bagi individu maupun organisasi.
- Meningkatkan Komunikasi: Standar ISO menciptakan bahasa visual yang universal, memudahkan kolaborasi internasional dan mengurangi risiko kesalahpahaman.
- Meningkatkan Efisiensi: Dengan standar yang jelas, proses desain, manufaktur, dan konstruksi menjadi lebih efisien dan terhindar dari revisi yang tidak perlu.
- Mengurangi Biaya: Kesalahan dan revisi yang minimal berdampak pada penghematan biaya produksi dan konstruksi.
- Meningkatkan Kualitas: Standarisasi memastikan kualitas gambar teknik yang konsisten dan terukur, menghasilkan produk akhir yang lebih baik.
- Memudahkan Perdagangan Internasional: Produk yang didesain dengan standar ISO lebih mudah diterima di pasar global.
Implementasi Standar ISO dalam Praktik Gambar Teknik
Standar ISO dalam gambar teknik bukan sekadar aturan, melainkan fondasi ketepatan, efisiensi, dan komunikasi efektif antar pihak dalam proyek rekayasa. Penerapannya memastikan keseragaman pemahaman gambar teknis, mengurangi ambiguitas, dan pada akhirnya, meminimalisir kesalahan yang berpotensi merugikan, baik dari segi waktu maupun biaya. Dari rancangan awal hingga konstruksi, standar ini berperan krusial dalam memastikan proyek berjalan lancar dan menghasilkan output yang sesuai harapan.
Penerapan standar ISO dalam gambar teknik bukan hanya sebatas mengikuti aturan, melainkan sebuah investasi jangka panjang untuk kualitas dan efisiensi. Bayangkan sebuah proyek konstruksi gedung pencakar langit, di mana setiap detail, setiap sambungan, dan setiap komponen harus terintegrasi sempurna. Ketidaksesuaian standar akan berujung pada pembengkakan biaya, keterlambatan proyek, bahkan potensi kecelakaan kerja. Dengan demikian, memahami dan menerapkan standar ISO menjadi kunci keberhasilan.
Penerapan Standar ISO dalam Berbagai Tahapan Pembuatan Gambar Teknik
Standar ISO merangkum berbagai aspek gambar teknik, mulai dari format kertas, skala, hingga simbol dan anotasi. Proses implementasinya terintegrasi di setiap tahapan, memastikan konsistensi dan kejelasan informasi. Dari tahap perencanaan awal, standar ISO memandu pemilihan skala yang tepat, penentuan format kertas, dan definisi sistem koordinat. Selama proses pembuatan gambar, standar ISO mendikte penggunaan simbol, toleransi, dan anotasi yang konsisten. Pada tahap finalisasi, standar ini memastikan kualitas gambar dan kemudahan dalam penyimpanan dan arsip.
Contoh Penerapan Standar ISO pada Jenis Gambar Teknik Tertentu
Ambil contoh gambar perakitan mesin. Standar ISO mendefinisikan cara menampilkan komponen-komponen, penomoran bagian, dan spesifikasi material. Setiap komponen digambarkan secara detail sesuai standar, dengan ukuran dan toleransi yang jelas. Sementara pada gambar detail, standar ISO mengatur tata letak, penamaan, dan penggambaran dimensi dengan tingkat presisi tinggi. Penggunaan standar ini memastikan setiap teknisi dapat memahami dan menginterpretasikan gambar dengan cara yang sama, meminimalisir potensi kesalahan interpretasi.
Standar ISO dalam gambar teknik krusial untuk memastikan konsistensi dan kejelasan informasi. Bayangkan, jika setiap insinyur punya standar sendiri, proyek konstruksi, misalnya, bisa kacau balau. Hal ini mirip dengan pemilihan bahan baku pembuatan panci; pemilihan material yang tepat sangat penting, seperti yang dijelaskan di panci dibuat dari bahan yang sifatnya berpengaruh pada daya tahan dan keamanan pengguna.
Kembali ke gambar teknik, standarisasi ISO memastikan semua pihak memahami dimensi, toleransi, dan simbol-simbol yang digunakan, mencegah kesalahan fatal dan memastikan efisiensi proyek. Dengan demikian, pentingnya standar ISO dalam dunia teknik tak perlu diragukan lagi.
Langkah-Langkah Pembuatan Gambar Teknik Sesuai Standar ISO
- Perencanaan dan Pengumpulan Data: Menentukan skala, format kertas, dan sistem koordinat yang sesuai dengan standar ISO.
- Pembuatan Sketsa Awal: Menggambar sketsa awal dengan memperhatikan proporsi dan detail yang relevan.
- Pembuatan Gambar Detail: Menggambar setiap komponen secara detail, dengan memperhatikan standar ISO untuk dimensi, toleransi, dan anotasi.
- Pembuatan Gambar Perakitan: Menggabungkan gambar detail menjadi gambar perakitan, dengan memperhatikan standar ISO untuk penomoran bagian dan tata letak.
- Penambahan Anotasi dan Spesifikasi: Menambahkan anotasi, spesifikasi material, dan informasi lainnya yang relevan, sesuai dengan standar ISO.
- Peninjauan dan Revisi: Meninjau gambar untuk memastikan kesesuaian dengan standar ISO dan kejelasan informasi.
- Finalisasi dan Arsip: Menyimpan gambar dalam format yang sesuai dan mengarsipkan gambar sesuai dengan standar ISO.
Interpretasi Gambar Teknik oleh Berbagai Pihak
Bayangkan sebuah proyek infrastruktur jalan raya. Para insinyur, kontraktor, dan pekerja lapangan semuanya membutuhkan pemahaman yang sama tentang gambar teknik. Standar ISO memastikan setiap pihak dapat menginterpretasikan gambar dengan akurat, mengurangi risiko kesalahan dan konflik. Sistem penomoran yang konsisten, simbol-simbol standar, dan anotasi yang jelas memungkinkan komunikasi yang efektif dan efisien antar pihak yang terlibat.
Contoh Gambar Teknik Sederhana dengan Penerapan Standar ISO
Sebuah gambar sederhana baut dan mur dapat menunjukkan penerapan beberapa standar ISO. Ukuran baut dan mur ditampilkan dengan dimensi yang akurat sesuai standar ISO. Toleransi ukuran juga dicantumkan dengan simbol dan angka yang sesuai standar. Material baut dan mur juga dijelaskan dengan kode material yang sesuai dengan standar ISO. Simbol kekencangan dan arah ulir juga ditampilkan dengan simbol standar ISO. Semua elemen ini, meskipun sederhana, menunjukkan bagaimana standar ISO memastikan kejelasan dan ketepatan informasi dalam gambar teknik.
Dampak Positif Penggunaan Standar ISO dalam Gambar Teknik: Mengapa Dalam Menggambar Teknik Diperlukan Standar Iso Jelaskan
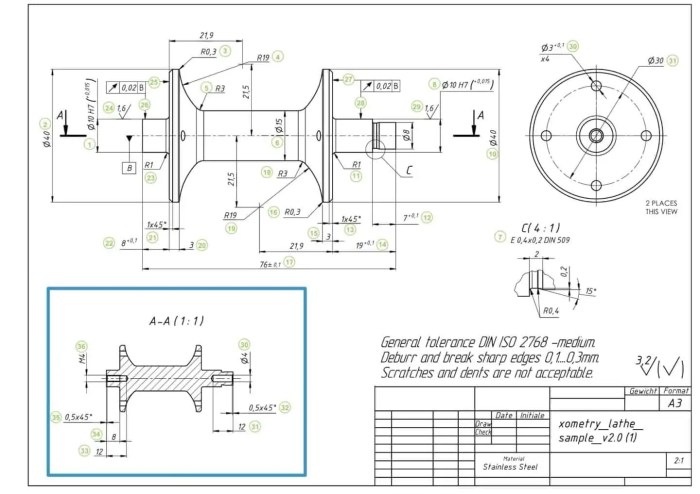
Standar ISO dalam gambar teknik bukan sekadar aturan, melainkan fondasi efisiensi dan keberhasilan proyek. Penerapannya secara konsisten menghasilkan dampak signifikan, mulai dari penghematan biaya hingga peningkatan kualitas produk akhir. Bayangkan sebuah proyek konstruksi gedung pencakar langit; ketidakjelasan dalam gambar teknik bisa berujung pada kesalahan fatal, kerugian finansial besar, bahkan kecelakaan kerja. Dengan standar ISO, risiko-risiko tersebut dapat diminimalisir secara efektif.
Efisiensi dan Produktivitas Proyek Teknik
Standar ISO, seperti ISO 128-20, memberikan kerangka kerja yang jelas dan terstruktur untuk pembuatan gambar teknik. Dengan terminologi, simbol, dan representasi yang seragam, proses desain, manufaktur, dan konstruksi menjadi lebih efisien. Para insinyur dan teknisi dapat dengan mudah memahami gambar, mengurangi waktu yang terbuang untuk interpretasi dan klarifikasi. Hasilnya? Peningkatan produktivitas yang signifikan, terutama dalam proyek berskala besar dan kompleks yang melibatkan banyak pihak.
Pengurangan Risiko Kesalahan dan Ambiguitas
Salah satu manfaat paling krusial dari standar ISO adalah minimnya ambiguitas. Bayangkan skenario di mana dua insinyur menafsirkan gambar teknik yang berbeda, meskipun merujuk pada desain yang sama. Standar ISO menghilangkan potensi konflik ini dengan memberikan definisi yang jelas dan konsisten untuk setiap elemen gambar. Akibatnya, risiko kesalahan desain, manufaktur, dan konstruksi berkurang drastis, menghindari pemborosan material, waktu, dan sumber daya.
Peningkatan Kolaborasi dan Komunikasi Antar Tim
Dalam proyek teknik modern, kolaborasi antar tim merupakan kunci keberhasilan. Standar ISO memfasilitasi komunikasi yang efektif dengan menyediakan bahasa visual yang universal. Tim desain, manufaktur, dan konstruksi dapat berkomunikasi dengan lebih mudah dan akurat, menghindari kesalahpahaman dan konflik. Hal ini mempercepat proses kerja, meningkatkan efisiensi, dan pada akhirnya menghasilkan produk berkualitas tinggi.
Tabel Dampak Positif Penggunaan Standar ISO
| Aspek Proyek | Dampak Positif Penggunaan Standar ISO | Contoh Kuantitatif | Ilustrasi Kualitatif |
|---|---|---|---|
| Biaya | Pengurangan biaya material, tenaga kerja, dan waktu | Penghematan 10-15% biaya proyek berdasarkan studi kasus proyek infrastruktur di negara X | Minimnya revisi desain dan konstruksi akibat kesalahpahaman |
| Waktu | Pengerjaan proyek lebih cepat dan tepat waktu | Penyelesaian proyek lebih cepat 5-10% dibandingkan proyek tanpa standar ISO | Alur kerja yang lebih lancar dan efisien |
| Kualitas | Meningkatkan akurasi dan presisi desain dan konstruksi | Peningkatan kualitas produk hingga 20% berdasarkan laporan kualitas proyek Y | Produk akhir yang lebih presisi dan sesuai spesifikasi |
Potensi Masalah yang Dapat Dihindari
Dengan mengadopsi standar ISO, berbagai potensi masalah dapat dihindari. Misalnya, kesalahan interpretasi gambar teknik yang dapat menyebabkan kecelakaan kerja, revisi desain berulang yang memakan biaya dan waktu, serta konflik antar tim yang menghambat kemajuan proyek. Penerapan standar ISO secara konsisten berarti mengurangi risiko kerugian finansial, memperbaiki reputasi perusahaan, dan meningkatkan kepuasan klien.
Ringkasan Terakhir
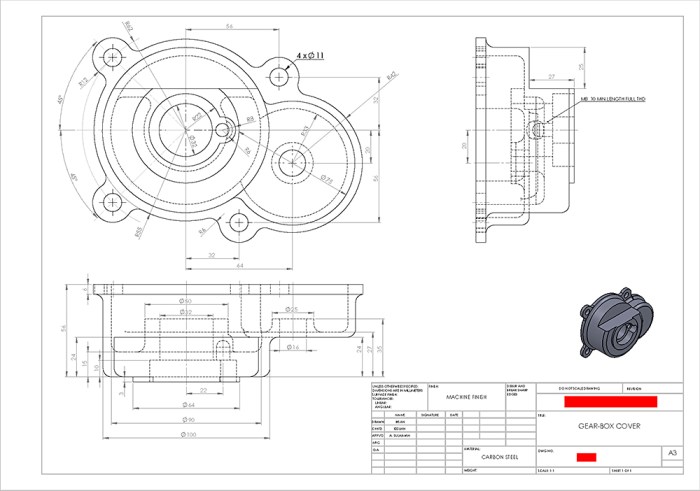
Kesimpulannya, penerapan standar ISO dalam menggambar teknik bukan sekadar rekomendasi, melainkan kebutuhan mutlak. Ini adalah investasi yang menguntungkan dalam jangka panjang, yang meminimalkan risiko, meningkatkan efisiensi, dan memastikan keselamatan. Dengan menggunakan bahasa universal yang dipahami secara global, kolaborasi antar tim dan negara menjadi lebih mudah, proyek berjalan lebih lancar, dan hasil akhir lebih terjamin kualitasnya. Mengabaikan standar ISO sama saja dengan mengundang potensi masalah dan kerugian yang dapat dihindari.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya