Larutan gula termasuk elektrolit – Larutan gula bukan elektrolit. Pernyataan ini mungkin terdengar sederhana, namun implikasinya luas dan memengaruhi berbagai aspek kehidupan kita, dari secangkir teh manis hingga proses industri yang kompleks. Memahami sifat larutan gula sebagai non-elektrolit, berbeda dengan larutan elektrolit seperti garam dapur, membuka jendela ke dunia kimia yang menarik. Mari kita telusuri perbedaan mendasar antara kedua jenis larutan ini, menganalisis perilaku mereka saat dialiri arus listrik, serta mengungkap aplikasi praktisnya dalam kehidupan sehari-hari dan industri.
Sifat larutan gula yang tidak menghantarkan listrik disebabkan oleh ketidakmampuannya untuk terionisasi dalam air. Berbeda dengan garam dapur (NaCl) yang terurai menjadi ion Na+ dan Cl- yang membawa muatan listrik, molekul gula tetap utuh dalam larutan. Perbedaan ini berdampak signifikan pada sifat fisik larutan, seperti titik didih dan titik beku. Lebih lanjut, pemahaman tentang interaksi antar molekul gula dan air membantu menjelaskan mengapa larutan gula memiliki sifat-sifat spesifiknya. Analisis komprehensif akan membandingkan larutan gula dengan larutan elektrolit untuk mengilustrasikan perbedaan yang fundamental ini.
Sifat Larutan Gula: Larutan Gula Termasuk Elektrolit
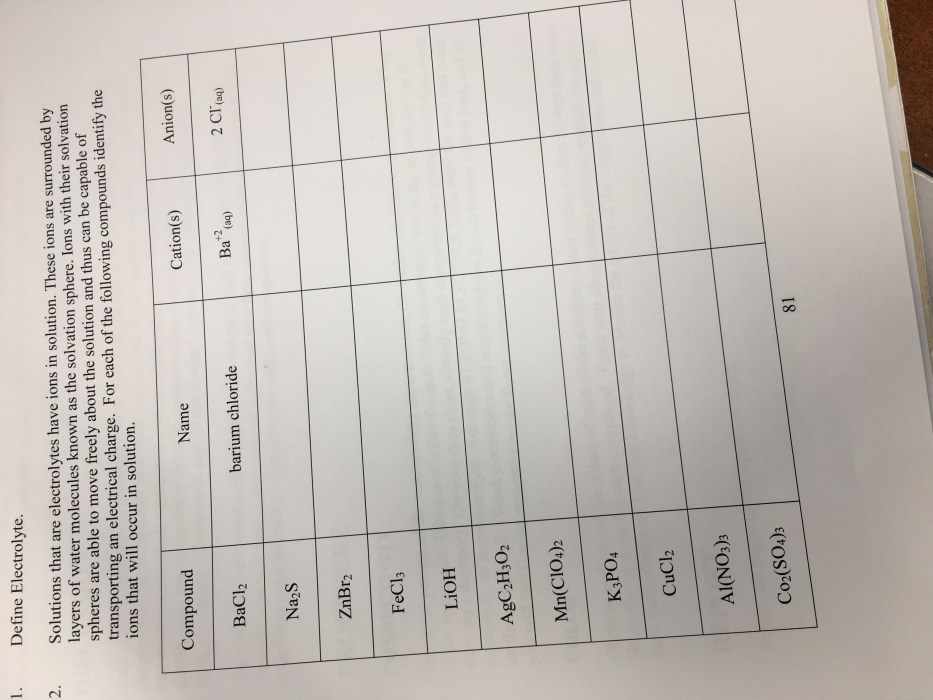
Larutan gula, yang umum kita jumpai dalam minuman manis sehari-hari, menyimpan karakteristik unik yang membedakannya dari jenis larutan lain. Memahami sifat-sifatnya, khususnya perbedaannya dengan larutan elektrolit, penting untuk mengerti bagaimana larutan ini berinteraksi dengan lingkungan dan berperan dalam berbagai aplikasi, dari industri makanan hingga proses biokimia dalam tubuh.
Larutan gula, berbeda dengan larutan garam, bukan elektrolit karena tidak menghasilkan ion dalam air. Namun, perbedaan konduktivitas listrik ini mengingatkan kita pada perbedaan emosi dalam musik; bagaimana sebuah melodi bisa begitu menyayat hati, seperti yang dijelaskan dalam artikel ini bagaimana tangga lagu yang memiliki sifat sedih dan haru , yang menggunakan tangga nada minor dan interval-interval tertentu untuk menciptakan suasana haru.
Kembali ke larutan gula, sifat non-elektrolitnya justru menunjukkan ketidakmampuannya menghantarkan arus listrik, sebuah kontras yang menarik dengan kompleksitas emosi manusia.
Larutan Gula sebagai Non-Elektrolit
Larutan gula, seperti larutan sukrosa dalam air, termasuk dalam kategori larutan non-elektrolit. Ini berarti ketika gula dilarutkan dalam air, molekul gula (sukrosa) tidak terurai menjadi ion-ion bermuatan. Molekul gula tetap utuh, tidak melepaskan ion positif maupun negatif ke dalam larutan. Kondisi ini berbeda dengan larutan elektrolit yang akan dibahas selanjutnya. Keutuhan molekul gula ini memiliki implikasi signifikan terhadap sifat-sifat fisika larutannya.
Contoh Larutan Non-Elektrolit dan Perbedaannya dengan Elektrolit
Selain larutan gula, contoh lain larutan non-elektrolit antara lain larutan alkohol (etanol) dalam air dan larutan urea dalam air. Perbedaan mendasar antara larutan non-elektrolit dan elektrolit terletak pada kemampuannya menghantarkan arus listrik. Larutan non-elektrolit, karena tidak memiliki ion bebas bergerak, tidak dapat menghantarkan arus listrik. Sebaliknya, larutan elektrolit, yang mengandung ion-ion bermuatan, dapat menghantarkan arus listrik dengan baik. Contoh larutan elektrolit adalah larutan garam dapur (NaCl) dalam air, dimana NaCl terdisosiasi menjadi ion Na+ dan Cl– yang membawa muatan listrik.
Larutan gula, meskipun sering dianggap sederhana, sebenarnya bukan elektrolit; ia tak menghantarkan listrik. Ini berbeda dengan garam dapur, misalnya. Namun, pemahaman mendalam tentang sifat larutan, seperti yang dipelajari dalam kimia, membuat saya merenungkan pertanyaan mendasar: mengapa saya ingin menjadi guru, sebuah pertanyaan yang jawabannya mungkin lebih kompleks daripada perbedaan antara elektrolit dan non-elektrolit. Mengapa ia ingin menjadi guru , pertanyaan itu mendorong saya untuk berbagi pengetahuan, seperti menjelaskan mengapa larutan gula bukan konduktor listrik yang baik karena molekulnya tak terurai menjadi ion-ion bermuatan.
Singkatnya, pemahaman mendasar tentang larutan gula, sebagai non-elektrolit, merupakan bagian kecil dari keinginan saya untuk mendidik dan menginspirasi.
Perbandingan Sifat Fisika Larutan Gula dan Elektrolit
Perbedaan sifat non-elektrolit dan elektrolit juga terlihat pada sifat-sifat fisikanya. Berikut perbandingan sifat fisika larutan gula (non-elektrolit) dan larutan elektrolit seperti NaCl:
| Sifat Fisika | Larutan Gula (Sukrosa) | Larutan Garam Dapur (NaCl) |
|---|---|---|
| Konduktivitas Listrik | Rendah, hampir tidak menghantarkan listrik | Tinggi, menghantarkan listrik dengan baik |
| Titik Didih | Meningkat sedikit dibandingkan air murni | Meningkat signifikan dibandingkan air murni |
| Titik Beku | Menurun sedikit dibandingkan air murni | Menurun signifikan dibandingkan air murni |
Perilaku Larutan Gula dan Elektrolit Saat Dialiri Arus Listrik
Ketika dialiri arus listrik, larutan gula tidak menunjukkan konduktivitas yang signifikan. Hal ini karena tidak adanya ion bermuatan bebas yang dapat membawa muatan listrik. Sebaliknya, larutan elektrolit akan menghantarkan arus listrik dengan baik karena adanya ion-ion bermuatan yang bergerak bebas dan membawa muatan tersebut melalui larutan. Perbedaan ini merupakan penanda utama yang membedakan kedua jenis larutan tersebut.
Disosiasi Ion pada Larutan Elektrolit dan Larutan Gula
Pada larutan elektrolit, senyawa ionik seperti NaCl terdisosiasi menjadi ion-ion penyusunnya ketika dilarutkan dalam air. Proses ini menghasilkan ion-ion bermuatan positif (kation) dan negatif (anion) yang bergerak bebas dalam larutan. Contohnya, NaCl (s) → Na+(aq) + Cl–(aq). Proses disosiasi ini tidak terjadi pada larutan gula. Molekul gula tetap utuh dan tidak melepaskan ion ke dalam larutan. Mereka hanya terdispersi di antara molekul air, tanpa membentuk ion-ion bermuatan.
Komponen Larutan Gula
Larutan gula, sederhana namun menyimpan kompleksitas interaksi molekuler yang menarik. Memahami komponen penyusunnya, serta bagaimana mereka berinteraksi, membuka jendela ke dunia kimia larutan dan sifat-sifatnya yang memengaruhi berbagai aspek kehidupan, mulai dari industri makanan hingga proses biologis di dalam tubuh kita. Berikut uraian detail mengenai komponen-komponen penyusun larutan gula dan perbandingannya dengan larutan elektrolit.
Komponen Penyusun Larutan Gula Sederhana
Larutan gula sederhana, seperti gula pasir (sukrosa) yang dilarutkan dalam air, terdiri dari dua komponen utama: gula (sebagai zat terlarut) dan air (sebagai pelarut). Sukrosa, molekul disakarida yang terdiri dari glukosa dan fruktosa, merupakan gula yang paling umum digunakan. Air, sebagai pelarut universal, memiliki peran vital dalam melarutkan gula dan membentuk larutan homogen.
Larutan gula, berbeda dengan garam, bukanlah elektrolit karena tidak menghasilkan ion dalam air. Ini berkaitan erat dengan pemahaman kita tentang energi, dan bagaimana kita mengaksesnya. Pertanyaannya, seberapa besar sih hak kita dalam mengakses energi, misalnya listrik? Mengetahui hak kita terhadap penggunaan sumber energi listrik, seperti yang dijelaskan di apa hakmu terhadap penggunaan sumber energi listrik , sangat penting.
Kembali ke larutan gula, sifat non-elektrolitnya menunjukkan ketidakmampuannya menghantarkan arus listrik, sebuah fenomena yang bertolak belakang dengan prinsip dasar pemanfaatan energi listrik.
Peran Masing-Masing Komponen dalam Larutan Gula, Larutan gula termasuk elektrolit
Gula, dalam hal ini sukrosa, bertindak sebagai zat terlarut. Molekul-molekul sukrosa tersebar merata di antara molekul-molekul air. Air, sebagai pelarut, melingkupi molekul-molekul sukrosa melalui ikatan hidrogen, mengurangi gaya tarik-menarik antar molekul sukrosa dan memungkinkan mereka untuk terpisah dan terdispersi. Proses pelarutan ini dipengaruhi oleh polaritas baik air maupun gula. Interaksi antarmolekul inilah yang menentukan sifat fisik larutan gula, seperti rasa manis dan viskositas.
Perbandingan Komposisi Larutan Gula dengan Larutan Elektrolit seperti NaCl
Berbeda dengan larutan gula, larutan elektrolit seperti NaCl (natrium klorida atau garam dapur) menghasilkan ion-ion ketika dilarutkan dalam air. NaCl terdisosiasi menjadi ion Na+ dan Cl–, yang membawa muatan listrik dan mampu menghantarkan arus listrik. Larutan gula, sebaliknya, tidak terionisasi dan tidak menghantarkan arus listrik. Perbedaan ini terletak pada jenis ikatan kimia yang menyatukan komponen-komponennya. NaCl memiliki ikatan ionik, sementara sukrosa memiliki ikatan kovalen.
Ilustrasi Detail Molekul Gula Terlarut dalam Air
Bayangkan molekul sukrosa, dengan struktur kompleksnya yang terdiri dari cincin-cincin karbon, hidrogen, dan oksigen, terendam dalam lautan molekul air. Molekul air, dengan sifat polarnya, terorientasi sedemikian rupa sehingga sisi negatif (oksigen) tertarik pada sisi positif dari molekul sukrosa, dan sebaliknya. Ikatan hidrogen terbentuk antara atom oksigen pada molekul air dan atom hidrogen pada gugus hidroksil (-OH) pada molekul sukrosa. Proses ini menghasilkan suatu struktur dimana molekul-molekul sukrosa terselubungi oleh molekul-molekul air, mencegah mereka bergumpal dan memastikan terbentuknya larutan homogen dan stabil.
Perbedaan Struktur Molekul Gula dengan Molekul Elektrolit
| Karakteristik | Molekul Gula (Sukrosa) | Molekul Elektrolit (NaCl) |
|---|---|---|
| Jenis Ikatan | Kovalen | Ionik |
| Kemampuan Ionisasi dalam Air | Tidak terionisasi | Terionisasi menjadi ion Na+ dan Cl– |
| Konduktivitas Listrik | Tidak menghantarkan listrik | Menghantarkan listrik |
| Struktur Molekul | Molekul netral dengan struktur cincin kompleks | Terdiri dari ion-ion bermuatan positif dan negatif |
Konduktivitas Listrik Larutan Gula

Larutan gula dan larutan garam dapur, meski sama-sama terlarut dalam air, menunjukkan perilaku yang sangat berbeda dalam hal kemampuan menghantarkan arus listrik. Perbedaan ini mendasar dan berakar pada sifat molekul zat terlarut itu sendiri. Memahami perbedaan konduktivitas listrik kedua larutan ini membuka jendela untuk memahami konsep dasar kimia larutan dan peranan ion dalam proses hantaran listrik.
Ketidakmampuan Larutan Gula Menghantarkan Arus Listrik
Larutan gula, yang terdiri dari molekul sukrosa (C12H22O11) terlarut dalam air, tidak menghantarkan arus listrik. Hal ini karena molekul sukrosa bersifat netral, tidak terionisasi dalam air. Tidak adanya ion-ion bermuatan bebas dalam larutan gula berarti tidak ada pembawa muatan untuk mengangkut arus listrik. Aliran arus listrik memerlukan medium yang mengandung partikel bermuatan yang dapat bergerak bebas di bawah pengaruh medan listrik. Molekul sukrosa, dengan ikatan kovalennya yang kuat, tidak menghasilkan ion-ion tersebut ketika dilarutkan dalam air.
Perbandingan Konduktivitas Listrik Larutan Gula dan Larutan Garam Dapur
Berbeda dengan larutan gula, larutan garam dapur (NaCl) merupakan konduktor listrik yang baik. NaCl, atau natrium klorida, adalah senyawa ionik yang terdisosiasi sempurna dalam air menjadi ion-ion Na+ dan Cl–. Ion-ion ini bergerak bebas dalam larutan, menjadi pembawa muatan yang memungkinkan arus listrik mengalir. Oleh karena itu, konduktivitas listrik larutan garam dapur jauh lebih tinggi daripada larutan gula yang praktis tidak menghantarkan listrik sama sekali.
Peran Ion dalam Hantaran Arus Listrik
Ion-ion dalam larutan elektrolit berperan sebagai pembawa muatan dalam proses hantaran arus listrik. Ketika medan listrik diterapkan pada larutan elektrolit, ion-ion bermuatan positif (kation) bergerak menuju kutub negatif (katoda), sementara ion-ion bermuatan negatif (anion) bergerak menuju kutub positif (anoda). Gerakan terarah ion-ion ini merupakan arus listrik. Semakin banyak jumlah ion dan semakin tinggi mobilitasnya, semakin tinggi pula konduktivitas listrik larutan tersebut. Ini menjelaskan mengapa larutan elektrolit dengan konsentrasi tinggi umumnya memiliki konduktivitas yang lebih tinggi.
Pengukuran Konduktivitas Listrik Larutan Gula dan Garam Dapur
- Siapkan larutan gula dan larutan garam dapur dengan konsentrasi yang sama (misalnya, 1 M).
- Kalibrasi konduktometer dengan menggunakan larutan standar yang diketahui konduktivitasnya.
- Celupkan probe konduktometer ke dalam larutan gula dan ukur konduktivitasnya. Catat hasilnya.
- Bersihkan probe konduktometer dengan air suling.
- Celupkan probe konduktometer ke dalam larutan garam dapur dan ukur konduktivitasnya. Catat hasilnya.
Perbedaan Hasil Pengukuran Konduktivitas Listrik
Sebagai contoh numerik, andaikan pengukuran menghasilkan konduktivitas larutan garam dapur sebesar 10 mS/cm (millisiemens per sentimeter), sementara konduktivitas larutan gula mendekati 0 mS/cm. Perbedaan yang signifikan ini menunjukkan perbedaan yang drastis dalam kemampuan kedua larutan untuk menghantarkan arus listrik. Hal ini secara langsung merefleksikan keberadaan dan mobilitas ion-ion dalam larutan.
Penerapan Larutan Gula dan Elektrolit

Larutan gula dan elektrolit, meskipun keduanya terlarut dalam air, memiliki peran yang sangat berbeda dalam kehidupan sehari-hari dan proses biologis. Perbedaan mendasar terletak pada kemampuannya menghantarkan listrik; gula merupakan non-elektrolit, sementara elektrolit menghantarkan arus listrik. Memahami perbedaan ini krusial untuk menghargai aplikasi masing-masing dan dampaknya terhadap kesehatan.
Penerapan Larutan Gula dalam Kehidupan Sehari-hari
Larutan gula, dalam bentuk sederhana seperti air gula, memiliki beragam aplikasi. Kehadirannya dalam minuman manis merupakan contoh yang paling umum. Selain itu, gula juga berperan sebagai pengawet dalam berbagai produk makanan, mencegah pertumbuhan mikroorganisme. Industri makanan dan minuman memanfaatkan sifat-sifat gula ini secara ekstensif. Gula juga digunakan dalam proses fermentasi, menjadi substrat bagi mikroorganisme untuk menghasilkan produk seperti alkohol dan asam organik. Bayangkan pembuatan tape, proses fermentasi yang bergantung pada gula sebagai sumber energi mikroba.
Penerapan Larutan Elektrolit dalam Kehidupan Sehari-hari dan Industri
Elektrolit, berbeda dengan gula, memiliki peran vital dalam berbagai aspek kehidupan. Dalam tubuh manusia, elektrolit seperti natrium, kalium, kalsium, dan magnesium mengatur keseimbangan cairan, transmisi impuls saraf, dan kontraksi otot. Minuman isotonik, umum dikonsumsi atlet, mengandung elektrolit untuk mengganti yang hilang selama berolahraga. Industri juga memanfaatkan elektrolit secara luas. Elektrolit dalam baterai, misalnya, memungkinkan aliran arus listrik untuk menghidupkan perangkat elektronik. Proses elektroplating, yang melapisi logam dengan lapisan pelindung, juga bergantung pada larutan elektrolit.
Perbedaan Aplikasi Larutan Gula dan Elektrolit Berdasarkan Sifat Kelistrikannya
Larutan gula, sebagai non-elektrolit, tidak dapat menghantarkan arus listrik karena molekulnya tidak terdisosiasi menjadi ion dalam larutan. Sebaliknya, larutan elektrolit, yang mengandung ion-ion bermuatan, merupakan konduktor listrik yang baik. Perbedaan sifat kelistrikan ini menentukan aplikasi masing-masing. Gula digunakan dalam aplikasi yang tidak memerlukan konduktivitas listrik, sementara elektrolit penting dalam aplikasi yang memanfaatkan aliran arus listrik.
Manfaat dan Risiko Penggunaan Larutan Gula dan Elektrolit yang Berlebihan
Konsumsi gula berlebih dikaitkan dengan berbagai masalah kesehatan, termasuk obesitas, diabetes tipe 2, dan penyakit jantung. Meskipun gula menyediakan energi, asupan berlebihan menyebabkan penumpukan lemak dan mengganggu metabolisme glukosa. Sebaliknya, kekurangan elektrolit dapat menyebabkan kram otot, kelelahan, dan bahkan gangguan jantung. Namun, kelebihan elektrolit juga berbahaya. Kelebihan natrium, misalnya, dapat meningkatkan tekanan darah dan risiko penyakit jantung. Keseimbangan adalah kunci; baik gula maupun elektrolit perlu dikonsumsi dalam jumlah yang tepat dan seimbang.
Mekanisme Kerja Larutan Gula dan Elektrolit dalam Tubuh Manusia
Gula, setelah dicerna, dipecah menjadi glukosa, sumber energi utama bagi sel-sel tubuh. Glukosa diserap ke dalam aliran darah dan digunakan untuk menghasilkan energi melalui proses respirasi seluler. Elektrolit, di sisi lain, berperan dalam berbagai proses fisiologis. Natrium dan kalium, misalnya, penting untuk transmisi impuls saraf dan kontraksi otot. Kalsium berperan dalam pembekuan darah dan kesehatan tulang. Magnesium terlibat dalam ratusan reaksi enzimatik dalam tubuh. Interaksi kompleks antara elektrolit ini memastikan fungsi tubuh yang optimal.
Penutupan
Kesimpulannya, pemahaman tentang perbedaan mendasar antara larutan gula dan elektrolit sangat krusial. Sifat non-elektrolit larutan gula membatasi penerapannya dalam konteks yang membutuhkan konduktivitas listrik, sementara elektrolit memiliki peran vital dalam berbagai aplikasi teknologi dan proses biologis. Perbedaan ini tidak hanya berdampak pada industri, tetapi juga mempengaruhi kesehatan kita, mengingat peran elektrolit dalam mempertahankan keseimbangan cairan tubuh. Memahami detail ini memberikan wawasan yang lebih dalam tentang dunia kimia dan aplikasinya di sekitar kita.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya



