Garam dapur termasuk elektrolit, sebuah fakta sederhana namun menyimpan keajaiban ilmiah dan dampak signifikan bagi kehidupan. Kristal putih yang sering kita gunakan untuk memasak ini, ternyata menyimpan potensi listrik ketika dilarutkan dalam air. Proses disosiasi garam dapur (NaCl) menghasilkan ion-ion bermuatan yang mampu menghantarkan arus listrik, sebuah fenomena dasar yang mendasari perannya dalam berbagai proses biologis dan industri. Dari menjaga keseimbangan elektrolit dalam tubuh hingga aplikasi dalam berbagai reaksi kimia, garam dapur membuktikan bahwa hal sederhana bisa menyimpan kompleksitas yang menakjubkan. Pemahaman mendalam tentang sifat elektrolit garam dapur membuka jendela ke dunia kimia dan biologi yang lebih luas.
Lebih dari sekadar bumbu penyedap, garam dapur memiliki peran krusial dalam menjaga keseimbangan tubuh. Ion natrium (Na+) dan klorida (Cl-), hasil disosiasi garam dapur, berperan vital dalam berbagai fungsi tubuh, mulai dari transmisi saraf hingga pengaturan tekanan darah. Kekurangan atau kelebihan keduanya bisa berdampak serius pada kesehatan. Sifat elektrolit garam dapur juga dimanfaatkan dalam berbagai aplikasi industri, mulai dari pengawetan makanan hingga proses elektrokimia. Eksplorasi lebih lanjut tentang sifat dan perannya membuka peluang untuk inovasi dan pemahaman yang lebih baik tentang dunia di sekitar kita.
Sifat Elektrolit Garam Dapur

Garam dapur, senyawa kimia yang akrab dalam kehidupan sehari-hari, ternyata menyimpan rahasia ilmiah yang menarik. Lebih dari sekadar penyedap rasa, garam dapur (NaCl) merupakan contoh klasik elektrolit, zat yang mampu menghantarkan arus listrik ketika dilarutkan dalam air. Pemahaman mengenai sifat elektrolit garam dapur membuka jendela pada dunia kimia larutan dan aplikasinya dalam berbagai bidang, dari industri hingga biologi.
Disosiasi Garam Dapur dalam Air
Ketika garam dapur dilarutkan dalam air, ikatan ionik antara ion natrium (Na+) dan ion klorida (Cl–) terputus. Proses ini disebut disosiasi. Molekul air, dengan sifat polarnya, mengelilingi ion-ion tersebut, menstabilkan muatannya dan mencegah ion-ion tersebut kembali bergabung. Proses ini menghasilkan larutan yang mengandung ion-ion bermuatan bebas, yang menjadi kunci kemampuan larutan garam dapur untuk menghantarkan listrik.
Garam dapur, natrium klorida (NaCl), merupakan elektrolit; larutannya menghantarkan listrik. Kemampuan menghantarkan listrik ini, sebagaimana kompleksnya dinamika politik abad ke-17, menunjukkan adanya interaksi. Perlawanan Sultan Ageng Tirtayasa, yang bisa kita pelajari lebih lanjut di alasan melakukan perlawanan Sultan Ageng Tirtayasa , juga menunjukkan interaksi kompleks antara kekuatan, kepentingan, dan ambisi. Sama seperti ion-ion dalam larutan garam dapur yang berinteraksi menciptakan daya hantar, begitu pula berbagai faktor yang saling mempengaruhi dalam pergolakan politik tersebut.
Singkatnya, kedua fenomena ini, garam dapur sebagai elektrolit dan perjuangan Sultan Ageng Tirtayasa, menunjukkan betapa interaksi antar komponen bisa menghasilkan dampak yang signifikan.
Ion-Ion yang Terbentuk
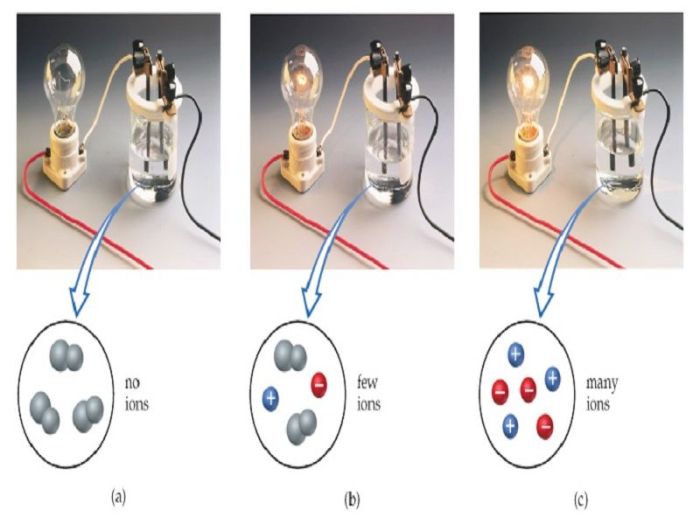
Disosiasi garam dapur (NaCl) dalam air menghasilkan dua jenis ion: ion natrium (Na+) yang bermuatan positif dan ion klorida (Cl–) yang bermuatan negatif. Jumlah ion Na+ dan Cl– yang dihasilkan seimbang, menjaga netralitas larutan secara keseluruhan. Keberadaan ion-ion bermuatan inilah yang memungkinkan larutan garam dapur untuk menghantarkan arus listrik.
Reaksi Disosiasi Garam Dapur
NaCl(s) → Na+(aq) + Cl–(aq)
Persamaan reaksi di atas menggambarkan proses disosiasi garam dapur. NaCl(s) menunjukkan garam dapur dalam bentuk padat, sementara Na+(aq) dan Cl–(aq) mewakili ion natrium dan klorida yang terlarut dalam air (aq = aqueous).
Konduktivitas Listrik Larutan Garam Dapur
Larutan garam dapur memiliki konduktivitas listrik yang tinggi. Hal ini disebabkan oleh keberadaan ion-ion bermuatan bebas (Na+ dan Cl–) yang dapat bergerak bebas dan membawa muatan listrik ketika medan listrik diterapkan. Semakin banyak ion yang ada dalam larutan, semakin tinggi pula konduktivitas listriknya. Sebaliknya, air murni dan larutan gula yang tidak mengandung ion memiliki konduktivitas listrik yang sangat rendah.
Perbandingan Konduktivitas Listrik
Tabel berikut membandingkan konduktivitas listrik larutan garam dapur, larutan gula, dan air murni. Nilai konduktivitas merupakan gambaran umum dan dapat bervariasi tergantung pada konsentrasi dan suhu.
Garam dapur, natrium klorida, merupakan elektrolit penting bagi tubuh. Namun, keseimbangan elektrolit tak hanya bergantung pada garam saja. Konsumsi sayuran sangat krusial, karena mengapa setiap orang disarankan untuk mengonsumsi sayuran setiap hari adalah untuk mendapatkan beragam nutrisi, termasuk mineral yang berperan dalam menjaga keseimbangan elektrolit, mencegah kekurangan mineral dan memastikan fungsi tubuh optimal.
Jadi, walaupun garam dapur merupakan elektrolit, pola makan seimbang kaya sayuran tetap kunci kesehatan. Mengingat perannya dalam menjaga keseimbangan elektrolit, konsumsi sayuran harus menjadi prioritas.
| Zat Terlarut | Rumus Kimia | Konduktivitas (mS/cm) | Keterangan |
|---|---|---|---|
| Garam Dapur | NaCl | Tinggi (misalnya, >100 mS/cm, tergantung konsentrasi) | Elektrolit kuat, banyak ion bebas |
| Gula | C12H22O11 | Rendah (mendekati 0 mS/cm) | Non-elektrolit, tidak menghasilkan ion |
| Air Murni | H2O | Sangat rendah (mendekati 0 mS/cm) | Non-elektrolit, sedikit sekali ion |
Peranan Ion dalam Larutan Garam Dapur
Garam dapur, natrium klorida (NaCl), lebih dari sekadar bumbu penyedap makanan. Keberadaannya krusial dalam menjaga keseimbangan elektrolit tubuh, sebuah proses yang tak terlihat namun vital bagi fungsi organ dan kelangsungan hidup. Memahami peran ion natrium (Na+) dan klorida (Cl-) dalam tubuh manusia, serta dampak kekurangan atau kelebihannya, membuka jendela mengenai pentingnya garam dapur dalam kehidupan kita sehari-hari. Mulai dari fungsi fisiologis hingga aplikasi praktisnya, garam dapur membuktikan dirinya sebagai senyawa sederhana dengan peran yang kompleks dan signifikan.
Larutan garam dapur dalam air terdisosiasi menjadi ion natrium (Na+) dan ion klorida (Cl−). Kedua ion ini berperan penting dalam berbagai proses fisiologis tubuh. Keberadaan ion-ion ini dalam konsentrasi yang tepat sangatlah penting. Kekurangan atau kelebihan keduanya dapat menimbulkan masalah kesehatan yang serius.
Peran Ion Natrium (Na+) dan Ion Klorida (Cl−) dalam Tubuh Manusia
Ion natrium berperan utama dalam pengaturan keseimbangan cairan tubuh, transmisi impuls saraf, dan kontraksi otot. Sementara itu, ion klorida berperan penting dalam menjaga keseimbangan asam basa dalam darah, serta membantu proses pencernaan. Keduanya bekerja sinergis untuk menjaga homeostasis tubuh. Bayangkan sebuah orkestra; setiap ion berperan sebagai instrumen yang saling mendukung untuk menghasilkan harmoni fisiologis yang optimal.
Dampak Kekurangan dan Kelebihan Ion Natrium dan Klorida
Defisiensi natrium, atau hiponatremia, dapat menyebabkan kelemahan otot, mual, muntah, bahkan kejang. Sebaliknya, kelebihan natrium, atau hipernatremia, dapat memicu dehidrasi, tekanan darah tinggi, dan masalah ginjal. Kekurangan klorida, atau hipokloremia, relatif jarang terjadi, namun dapat mengakibatkan gangguan keseimbangan asam basa dan penurunan produksi asam lambung. Sedangkan kelebihan klorida, atau hiperkloremia, sering dikaitkan dengan masalah ginjal dan asidosis metabolik. Kondisi-kondisi ini menggambarkan betapa pentingnya menjaga keseimbangan elektrolit yang tepat. Konsultasi dengan tenaga medis profesional sangat dianjurkan jika mengalami gejala-gejala tersebut.
Aplikasi Garam Dapur dalam Kehidupan Sehari-hari
Sifat elektrolit garam dapur dimanfaatkan dalam berbagai aplikasi, dari yang sederhana hingga yang kompleks. Dalam industri makanan, garam berfungsi sebagai pengawet dan penyedap rasa. Dalam industri kimia, garam digunakan dalam proses elektrolisis untuk menghasilkan logam alkali dan klorin. Di bidang medis, larutan garam isotonik digunakan untuk rehidrasi pasien. Penggunaan ini menunjukkan fleksibilitas dan nilai ekonomis garam dapur. Sebagai contoh, proses pengawetan makanan memanfaatkan sifat garam sebagai anti bakteri, mencegah pertumbuhan mikroorganisme yang merugikan.
Peran Garam Dapur dalam Menjaga Keseimbangan Elektrolit
Garam dapur merupakan sumber utama natrium dan klorida dalam diet manusia. Asupan natrium dan klorida yang cukup, dalam jumlah yang tepat, sangat penting untuk menjaga keseimbangan elektrolit dalam tubuh. Ginjal berperan penting dalam mengatur kadar natrium dan klorida dalam darah. Jika terjadi ketidakseimbangan, ginjal akan bekerja lebih keras untuk mengembalikan keseimbangan tersebut. Namun, beban kerja ginjal yang berlebihan dalam jangka panjang dapat berdampak negatif bagi kesehatan.
Manfaat Garam Dapur bagi Kesehatan (Ringkasan)
- Menjaga keseimbangan cairan tubuh.
- Membantu transmisi impuls saraf dan kontraksi otot.
- Mengatur keseimbangan asam basa dalam darah.
- Membantu proses pencernaan.
- Berperan dalam fungsi berbagai enzim.
Garam Dapur dan Reaksi Kimia
Natrium klorida, atau yang lebih dikenal sebagai garam dapur, lebih dari sekadar bumbu penyedap makanan. Senyawa ionik ini berperan penting dalam berbagai reaksi kimia, menunjukkan sifat elektrolitnya yang vital dalam berbagai proses, mulai dari reaksi sederhana hingga yang kompleks dalam skala industri. Pemahaman mendalam tentang bagaimana garam dapur berinteraksi dengan zat lain membuka jalan bagi inovasi dalam berbagai bidang, termasuk industri kimia dan teknologi material.
Garam dapur, natrium klorida (NaCl), merupakan elektrolit yang mudah larut dalam air. Kemampuannya menghantarkan listrik ini berbeda dengan dinamika permainan sepak bola, khususnya pada situasi tegang seperti penalti. Jarak ideal tendangan penalti, seperti yang dijelaskan di jarak tendangan penalti pada permainan sepak bola , membutuhkan kalkulasi presisi dan kecepatan.
Kembali pada garam, ion-ion Na+ dan Cl- yang terbentuk saat NaCl larut menunjukkan sifat elektrolit yang menarik untuk dipelajari, mirip dengan kompleksitas strategi dalam sebuah pertandingan sepak bola.
Reaksi Garam Dapur dengan Asam dan Basa
Garam dapur, sebagai garam netral, bereaksi berbeda dengan asam dan basa. Reaksi dengan asam kuat dapat menghasilkan asam yang lebih lemah dan garam baru. Sebaliknya, reaksi dengan basa kuat menghasilkan basa yang lebih lemah dan garam baru. Sifat ini menjadikannya komponen kunci dalam berbagai reaksi kimia, menunjukkan kemampuannya untuk menstabilkan pH suatu larutan.
Reaksi Garam Dapur dengan Asam Sulfat
Reaksi antara garam dapur (NaCl) dan asam sulfat pekat (H₂SO₄) menghasilkan hidrogen klorida (HCl) dan natrium hidrogen sulfat (NaHSO₄). Reaksi ini merupakan contoh reaksi pertukaran ganda atau metatesis. Persamaan reaksi yang terjadi adalah: NaCl(s) + H₂SO₄(l) → HCl(g) + NaHSO₄(s).
Produk Reaksi Garam Dapur dengan Perak Nitrat
Ketika garam dapur bereaksi dengan larutan perak nitrat (AgNO₃), terbentuk endapan putih perak klorida (AgCl) yang tidak larut dalam air. Reaksi ini sering digunakan sebagai uji kualitatif untuk keberadaan ion klorida. Persamaan reaksinya adalah: NaCl(aq) + AgNO₃(aq) → AgCl(s) + NaNO₃(aq). Endapan AgCl ini menunjukkan pembentukan ikatan ionik yang kuat antara ion perak dan klorida.
Perbedaan Reaksi Garam Dapur dengan Logam dan Non-logam
Garam dapur menunjukkan perbedaan reaksi yang signifikan ketika berinteraksi dengan logam dan non-logam. Dengan logam reaktif, garam dapur dapat mengalami reaksi redoks, di mana terjadi transfer elektron. Namun, dengan non-logam, reaksi cenderung berupa reaksi pertukaran ganda atau reaksi asam-basa, bergantung pada sifat non-logam yang bersangkutan. Reaksi dengan logam alkali misalnya, cenderung lebih reaktif dibanding dengan logam transisi.
Peran Garam Dapur dalam Reaksi Netralisasi
Garam dapur, sebagai produk reaksi netralisasi antara asam kuat dan basa kuat, tidak menunjukkan sifat asam maupun basa. Ini menunjukkan kesetimbangan antara ion H⁺ dan OH⁻ dalam larutan. Keberadaan garam dapur dalam reaksi netralisasi dapat memengaruhi pH larutan akhir, tergantung pada kekuatan asam dan basa yang bereaksi. Proses ini penting dalam berbagai aplikasi, termasuk dalam pengolahan air dan pengaturan pH dalam berbagai proses industri.
Pengaruh Konsentrasi terhadap Konduktivitas Larutan Garam Dapur: Garam Dapur Termasuk Elektrolit
Garam dapur, natrium klorida (NaCl), dalam larutan air berperan sebagai elektrolit, melepaskan ion-ion bermuatan yang menghantarkan listrik. Namun, kemampuannya menghantarkan arus listrik tak lepas dari konsentrasi larutan itu sendiri. Semakin banyak garam yang terlarut, semakin besar pula potensi konduktivitasnya. Fenomena ini krusial dalam berbagai aplikasi, mulai dari industri hingga laboratorium, sehingga pemahaman mendalam tentang hubungan konsentrasi dan konduktivitas sangat penting.
Hubungan Konsentrasi dan Konduktivitas
Konduktivitas larutan garam dapur berbanding lurus dengan konsentrasinya. Semakin tinggi konsentrasi garam (jumlah garam yang terlarut dalam volume air tertentu), semakin banyak ion Na+ dan Cl– yang tersedia untuk membawa muatan listrik. Hal ini menyebabkan peningkatan jumlah pembawa muatan, sehingga meningkatkan kemampuan larutan untuk menghantarkan arus listrik. Bayangkan seperti jalan raya: semakin banyak kendaraan (ion), semakin lancar arus lalu lintas (arus listrik).
Grafik Hubungan Konsentrasi dan Konduktivitas
Grafik hubungan antara konsentrasi larutan garam dapur dan konduktivitasnya akan berbentuk kurva. Sumbu-x mewakili konsentrasi garam (misalnya, dalam satuan molaritas atau gram per liter), sedangkan sumbu-y mewakili konduktivitas (misalnya, dalam satuan Siemens per meter atau mS/cm). Kurva tersebut akan cenderung naik secara tidak linier. Pada konsentrasi rendah, peningkatan konduktivitas cukup signifikan seiring bertambahnya konsentrasi. Namun, pada konsentrasi tinggi, peningkatan konduktivitas akan semakin landai karena interaksi antar ion mulai mempengaruhi mobilitas ion-ion tersebut. Secara visual, grafik ini menyerupai kurva sigmoid, yang awalnya menanjak tajam, kemudian semakin mendatar seiring meningkatnya konsentrasi.
Ilustrasi Perbedaan Tingkat Konduktivitas
Bayangkan tiga gelas berisi larutan garam dapur dengan konsentrasi berbeda: rendah, sedang, dan tinggi. Gelas dengan konsentrasi rendah akan memiliki sedikit ion, sehingga lampu indikator pada alat pengukur konduktivitas akan menyala redup. Gelas dengan konsentrasi sedang akan menunjukkan cahaya yang lebih terang, menandakan konduktivitas yang lebih tinggi karena jumlah ion yang lebih banyak. Sementara itu, gelas dengan konsentrasi tinggi akan memiliki cahaya paling terang, menunjukkan konduktivitas yang paling tinggi. Perbedaan kecerahan lampu ini mencerminkan perbedaan jumlah ion yang tersedia untuk menghantarkan arus listrik.
Perbandingan Konduktivitas Larutan Garam Dapur, Garam dapur termasuk elektrolit
Perbandingan langsung konduktivitas antara larutan garam dapur dengan konsentrasi berbeda menunjukkan peningkatan yang signifikan seiring bertambahnya konsentrasi, sampai batas tertentu. Misalnya, larutan 0,1 M NaCl akan memiliki konduktivitas yang jauh lebih rendah daripada larutan 1 M NaCl. Namun, perbedaan antara larutan 1 M dan 2 M NaCl mungkin tidak seluas perbedaan antara 0,1 M dan 1 M NaCl, karena efek interaksi ion pada konsentrasi tinggi.
Langkah-langkah Percobaan Sederhana
- Siapkan larutan garam dapur dengan berbagai konsentrasi (misalnya, 0,1 M, 0,5 M, 1 M, dan 2 M).
- Gunakan konduktometer untuk mengukur konduktivitas setiap larutan.
- Catat nilai konduktivitas untuk setiap konsentrasi.
- Buat grafik hubungan antara konsentrasi dan konduktivitas.
- Analisis data dan simpulkan hubungan antara konsentrasi larutan garam dapur dan konduktivitasnya.
Terakhir
Garam dapur, lebih dari sekadar bumbu dapur, merupakan contoh nyata bagaimana suatu zat sederhana dapat memiliki peran yang kompleks dan vital. Sifatnya sebagai elektrolit, kemampuannya untuk menghantarkan listrik ketika terlarut dalam air, menjadi kunci pemahaman perannya dalam sistem biologis dan berbagai reaksi kimia. Dari menjaga keseimbangan elektrolit dalam tubuh hingga aplikasi dalam industri, garam dapur menunjukkan pentingnya pengetahuan dasar ilmu kimia dalam kehidupan sehari-hari. Memahami sifat elektrolit garam dapur bukan hanya sekadar pengetahuan ilmiah, tetapi juga kunci untuk menghargai kompleksitas alam dan potensi yang tersembunyi di balik zat-zat sederhana.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya



