H2o polar atau nonpolar – H2O: Polar atau Nonpolar? Pertanyaan sederhana ini menyimpan jawaban yang mendalam tentang sifat dasar air, zat yang begitu vital bagi kehidupan. Mempelajari polaritas air bukan sekadar memahami ikatan kimia, melainkan kunci untuk mengungkap misteri bagaimana air melarutkan berbagai zat, menentukan titik didihnya yang tinggi, dan berperan krusial dalam proses biologis. Dari struktur molekulnya yang unik hingga perannya dalam ekosistem, perjalanan kita menjelajahi dunia polaritas air akan membuka wawasan baru tentang fenomena alamiah yang sering kita anggap biasa saja. Kita akan menyelami detail interaksi molekul, membandingkan air dengan senyawa lain, dan mengkaji implikasi praktis dari sifat polar air ini.
Memahami polaritas air berarti memahami bagaimana perbedaan elektronegativitas antara atom oksigen dan hidrogen menciptakan distribusi muatan yang tidak merata. Ini menghasilkan momen dipol, sebuah karakteristik kunci yang menjelaskan interaksi air dengan berbagai zat. Konsep “like dissolves like” akan menjadi pusat pembahasan, menjelaskan mengapa air, sebagai pelarut polar, mampu melarutkan zat-zat polar lainnya, sementara zat nonpolar cenderung tidak larut di dalamnya. Kita akan menganalisis ikatan hidrogen, sebuah interaksi antarmolekul yang kuat yang bertanggung jawab atas banyak sifat unik air. Perbandingan dengan molekul lain seperti CO2 akan memperjelas perbedaan dan konsekuensinya.
Struktur Molekul H2O
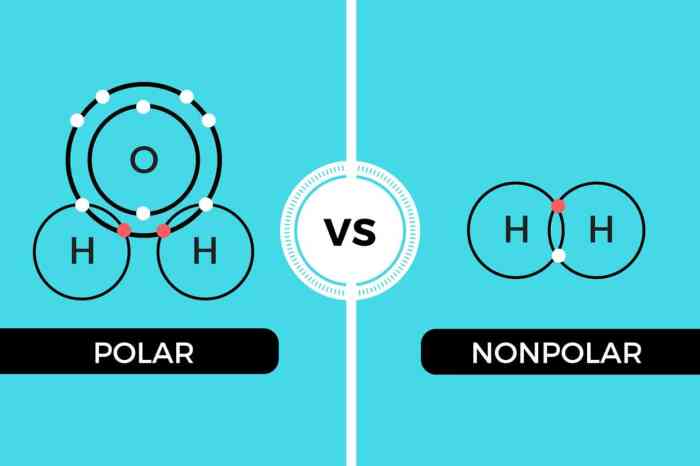
Air, senyawa kimia yang paling vital bagi kehidupan di Bumi, memiliki struktur molekul yang unik dan menentukan sifat-sifatnya yang luar biasa. Pemahaman mendalam tentang geometri molekul, distribusi muatan, dan jenis ikatan dalam H₂O sangat krusial untuk menjelaskan mengapa air berperan begitu penting dalam berbagai proses biologis dan geofisik. Dari sifat pelarutnya yang universal hingga perannya dalam regulasi suhu planet, semuanya berakar pada karakteristik molekulnya yang polar.
Geometri Molekul Air
Molekul air (H₂O) memiliki geometri bengkok atau bentuk V. Atom oksigen berada di pusat, terikat pada dua atom hidrogen. Sudut ikatan antara kedua atom hidrogen sekitar 104,5 derajat, bukan 180 derajat seperti yang diharapkan dalam geometri linear. Bentuk bengkok ini disebabkan oleh adanya pasangan elektron bebas pada atom oksigen yang saling tolak-menolak, sehingga mendorong atom hidrogen lebih dekat satu sama lain.
Distribusi Muatan Elektron dalam Molekul H₂O
Oksigen memiliki elektronegativitas yang jauh lebih tinggi daripada hidrogen. Ini berarti atom oksigen menarik elektron ikatan lebih kuat daripada atom hidrogen. Akibatnya, terjadi distribusi muatan elektron yang tidak merata. Atom oksigen memiliki muatan parsial negatif (δ-), sedangkan atom hidrogen memiliki muatan parsial positif (δ+). Perbedaan muatan ini menciptakan dipol listrik, menjadi kunci polaritas molekul air.
Jenis Ikatan Kimia dalam Molekul H₂O
Ikatan kimia yang menyatukan atom-atom dalam molekul air adalah ikatan kovalen polar. Ikatan kovalen terbentuk karena pemakaian bersama pasangan elektron antara atom oksigen dan masing-masing atom hidrogen. Namun, karena perbedaan elektronegativitas yang signifikan, pemakaian bersama elektron tersebut tidak merata, sehingga menghasilkan ikatan kovalen polar dengan distribusi muatan yang asimetris.
Perbandingan Elektronegativitas Atom Hidrogen dan Oksigen
| Atom | Elektronegativitas (Skala Pauling) |
|---|---|
| Hidrogen (H) | 2.2 |
| Oksigen (O) | 3.44 |
Tabel di atas menunjukkan perbedaan elektronegativitas yang cukup besar antara oksigen dan hidrogen. Perbedaan ini menjadi faktor utama yang menyebabkan polaritas ikatan O-H dalam molekul air.
Pengaruh Perbedaan Elektronegativitas terhadap Polaritas Ikatan
Perbedaan elektronegativitas antara oksigen dan hidrogen menyebabkan elektron ikatan lebih tertarik ke atom oksigen yang lebih elektronegatif. Hal ini menghasilkan distribusi muatan yang tidak merata, dengan atom oksigen bermuatan parsial negatif dan atom hidrogen bermuatan parsial positif. Ketidakmerataan distribusi muatan ini menciptakan momen dipol, menjadikan ikatan O-H sebagai ikatan polar dan molekul H₂O secara keseluruhan bersifat polar.
Polaritas Ikatan dan Molekul
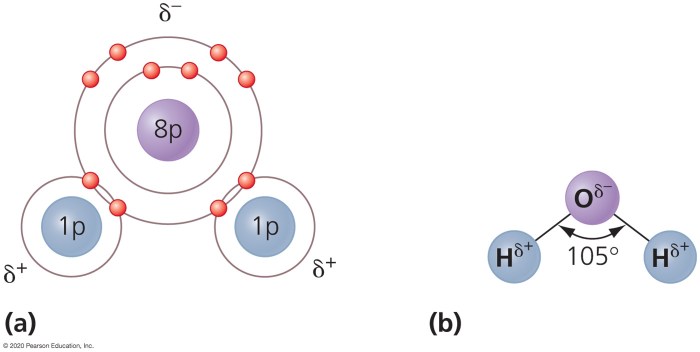
Air, senyawa yang begitu vital bagi kehidupan, menyimpan rahasia sederhana namun mendalam dalam strukturnya: polaritas. Pemahaman tentang polaritas ikatan dan molekul merupakan kunci untuk mengungkap sifat-sifat fisik dan kimia berbagai zat, termasuk bagaimana air melarutkan garam, mengapa minyak dan air tidak bercampur, dan banyak lagi fenomena sehari-hari lainnya. Lebih dari sekadar teori, ini adalah fondasi yang menopang berbagai aplikasi, dari pengembangan material hingga pemahaman proses biologis.
Perbedaan Ikatan Polar dan Nonpolar
Polaritas suatu ikatan kimia ditentukan oleh perbedaan elektronegativitas atom-atom yang terlibat. Elektronegativitas mengukur kemampuan suatu atom untuk menarik elektron dalam ikatan. Jika perbedaan elektronegativitas antara dua atom cukup besar, elektron ikatan akan lebih tertarik ke atom yang lebih elektronegatif, menciptakan ikatan polar dengan distribusi muatan yang tidak merata. Sebaliknya, jika perbedaan elektronegativitasnya kecil atau mendekati nol, elektron ikatan terdistribusi secara merata, menghasilkan ikatan nonpolar. Bayangkan sebuah tarik menarik antara dua magnet dengan kekuatan yang berbeda; semakin besar perbedaan kekuatannya, semakin besar pula polaritasnya.
Contoh Ikatan Polar dan Nonpolar
Air (H₂O) merupakan contoh klasik ikatan polar. Oksigen lebih elektronegatif daripada hidrogen, sehingga elektron ikatan lebih dekat ke atom oksigen, menciptakan dipol dengan ujung negatif parsial (δ-) pada oksigen dan ujung positif parsial (δ+) pada hidrogen. Sebagai perbandingan, ikatan dalam molekul hidrogen (H₂) bersifat nonpolar karena kedua atom hidrogen memiliki elektronegativitas yang sama. Contoh lain ikatan polar adalah ikatan antara hidrogen dan klorin dalam asam klorida (HCl), sementara ikatan dalam molekul oksigen (O₂) merupakan contoh ikatan nonpolar.
- Ikatan Polar: HCl, HF, NH₃
- Ikatan Nonpolar: H₂, Cl₂, O₂, CH₄
Momen Dipol dan Polaritas Molekul
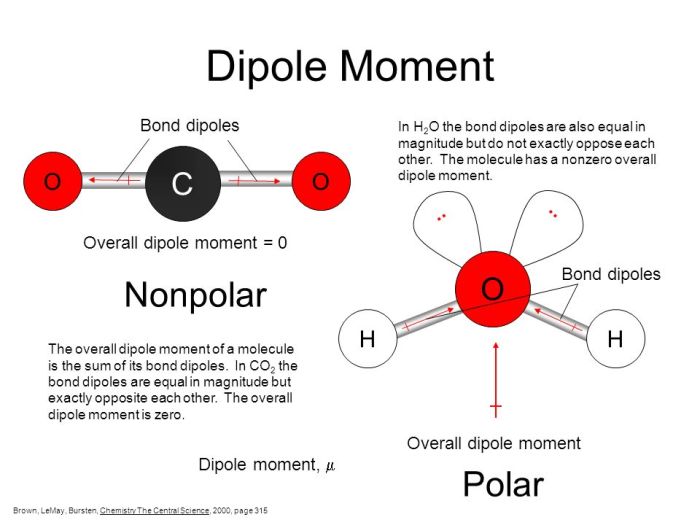
Momen dipol merupakan besaran vektor yang mengukur besarnya dan arah polaritas suatu ikatan atau molekul. Ia dihitung dengan mengalikan besarnya muatan parsial dengan jarak antara muatan positif dan negatif parsial. Dalam molekul poliatomik, momen dipol total merupakan resultan vektor dari momen dipol individual setiap ikatan. Jika resultan momen dipolnya nol, molekul tersebut bersifat nonpolar, meskipun mungkin mengandung ikatan polar. Sebaliknya, jika resultan momen dipolnya tidak nol, molekul tersebut bersifat polar.
Perhitungan Momen Dipol H₂O (Secara Skematis)
Molekul air (H₂O) memiliki bentuk bengkok (non-linear). Kedua ikatan O-H bersifat polar, dengan atom oksigen yang lebih elektronegatif menarik elektron lebih dekat. Karena bentuk molekulnya yang bengkok, momen dipol individual dari kedua ikatan O-H tidak saling meniadakan, melainkan saling memperkuat, menghasilkan momen dipol total yang tidak nol. Secara skematis, kita bisa menggambarkannya sebagai dua vektor yang membentuk sudut tertentu, resultan vektornya menunjukkan momen dipol total molekul H₂O yang berarah ke atom oksigen.
Karakteristik Molekul Polar dan Nonpolar
| Karakteristik | Molekul Polar | Molekul Nonpolar |
|---|---|---|
| Distribusi Elektron | Tidak merata | Merata |
| Momen Dipol | Tidak nol | Nol |
| Titik Didih/Titik Leleh | Umumnya lebih tinggi | Umumnya lebih rendah |
| Kelarutan dalam Air | Umumnya larut | Umumnya tidak larut |
Sifat-Sifat H2O yang Dipengaruhi Polaritas
Air, senyawa kimia sederhana dengan rumus H₂O, memiliki peran krusial dalam kehidupan di Bumi. Keunikan air tak lepas dari sifat polarnya, yang berdampak signifikan pada berbagai sifat fisik dan kimia. Polaritas ini, yang disebabkan oleh perbedaan elektronegativitas antara atom oksigen dan hidrogen, menentukan bagaimana molekul air berinteraksi satu sama lain dan dengan molekul lain, mempengaruhi berbagai proses penting, dari titik didih hingga peran biologisnya yang kompleks.
Pengaruh Polaritas terhadap Titik Didih Air
Titik didih air yang relatif tinggi (100°C pada tekanan atmosfer standar) merupakan konsekuensi langsung dari polaritasnya. Ikatan hidrogen, interaksi antarmolekul yang kuat yang terbentuk antara atom hidrogen yang sedikit positif dari satu molekul air dengan atom oksigen yang sedikit negatif dari molekul air lain, membutuhkan energi yang signifikan untuk diputus. Energi yang dibutuhkan untuk mengatasi ikatan hidrogen ini jauh lebih besar dibandingkan dengan energi yang dibutuhkan untuk mengatasi gaya antarmolekul yang lebih lemah pada senyawa nonpolar dengan berat molekul sebanding. Akibatnya, air memiliki titik didih yang jauh lebih tinggi daripada senyawa sejenis seperti hidrogen sulfida (H₂S), yang nonpolar.
Kemampuan Air Melarutkan Zat
Sifat polar air berperan penting dalam kemampuannya melarutkan berbagai zat. Air dikenal sebagai “pelarut universal” karena mampu melarutkan banyak senyawa ionik dan polar. Molekul air, dengan kutub positif dan negatifnya, dapat mengelilingi ion-ion dalam senyawa ionik, menetralkan gaya tarik-menarik antarion dan memisahkannya. Proses ini disebut solvasi atau hidratasi. Senyawa polar juga dapat larut dalam air karena molekul air dapat membentuk ikatan hidrogen dengan molekul terlarut, mengurangi gaya tarik-menarik antarmolekul terlarut dan memfasilitasi pelarutan.
Interaksi Antarmolekul dalam Air: Ikatan Hidrogen
Ikatan hidrogen adalah kunci pemahaman sifat-sifat unik air. Ikatan ini terbentuk karena adanya perbedaan elektronegativitas yang signifikan antara atom oksigen dan hidrogen dalam molekul air. Atom oksigen, lebih elektronegatif, menarik elektron lebih kuat daripada atom hidrogen, menciptakan muatan parsial negatif (δ-) pada oksigen dan muatan parsial positif (δ+) pada hidrogen. Interaksi elektrostatis antara δ+ hidrogen dari satu molekul air dan δ- oksigen dari molekul air lain membentuk ikatan hidrogen. Ikatan ini lebih lemah daripada ikatan kovalen, tetapi cukup kuat untuk mempengaruhi sifat fisik air secara signifikan.
Ilustrasi Interaksi Molekul Air melalui Ikatan Hidrogen
Bayangkan sebuah molekul air sebagai sebuah dipol kecil, dengan atom oksigen di pusat dan dua atom hidrogen sedikit menjauh. Atom oksigen memiliki muatan parsial negatif, sementara atom hidrogen memiliki muatan parsial positif. Sekarang, bayangkan beberapa molekul air berdekatan. Atom hidrogen dari satu molekul akan tertarik ke atom oksigen dari molekul tetangganya, membentuk ikatan hidrogen. Ini menciptakan jaringan molekul air yang saling terhubung, seperti sebuah jaring yang kompleks. Jaringan ini memberikan air sifat-sifat uniknya, seperti tegangan permukaan yang tinggi dan panas penguapan yang tinggi. Bentuk molekul air yang bengkok juga memungkinkan setiap molekul air untuk membentuk ikatan hidrogen dengan hingga empat molekul air lainnya, meningkatkan kekuatan jaringan ini.
Air (H₂O), dengan ikatan polarnya yang kuat, menunjukkan sifat unik. Sifat ini, sebagaimana beragamnya pilihan hidup, mengajarkan kita pentingnya toleransi. Memahami mengapa molekul air bersifat polar selayaknya kita memahami mengapa kita harus menghormati pilihan teman , karena perbedaan, seperti polaritas dan nonpolaritas, merupakan bagian integral dari keragaman.
Begitu pula dalam kehidupan sosial, menghargai perbedaan penting untuk menciptakan keselarasan, sebagaimana interaksi antar molekul air yang menentukan sifat-sifat uniknya. Jadi, mengenal polaritas H₂O juga membawa kita pada pemahaman tentang pentingnya toleransi dan penerimaan terhadap perbedaan.
Peran Polaritas H2O dalam Proses Biologis
Polaritas air sangat penting untuk kehidupan. Sebagai pelarut utama dalam sistem biologis, air memungkinkan terjadinya reaksi biokimia di dalam sel. Air berperan sebagai media transportasi nutrisi dan zat sisa, dan terlibat dalam berbagai proses seluler, termasuk fotosintesis dan respirasi. Ikatan hidrogen dalam air juga berkontribusi pada struktur dan fungsi makromolekul biologis seperti protein dan asam nukleat. Struktur tiga dimensi protein, misalnya, dipengaruhi oleh ikatan hidrogen antara gugus polar dalam rantai asam amino. Tanpa sifat polar air, kehidupan seperti yang kita kenal tidak akan mungkin ada.
Sifat polar air (H₂O) yang unik, dengan muatan positif dan negatif parsial, seringkali dianalogikan dengan dinamika sosial. Perbedaan tersebut, layaknya perbedaan pendapat antar siswa, dapat memicu konflik. Lihat saja beragam contoh konflik sosial di sekolah , dari perselisihan antar kelompok hingga perebutan kekuasaan dalam organisasi siswa. Sama seperti molekul air yang berinteraksi melalui ikatan hidrogen, interaksi sosial di sekolah pun rumit dan dipengaruhi berbagai faktor.
Pemahaman sifat polar air, sebagaimana pemahaman dinamika sosial, membutuhkan analisis yang cermat untuk mengurai kompleksitasnya.
Perbandingan H2O dengan Molekul Lain: H2o Polar Atau Nonpolar
Air, senyawa kimia yang paling vital bagi kehidupan, memiliki sifat unik yang sebagian besar ditentukan oleh polaritasnya. Memahami polaritas air membutuhkan perbandingan dengan molekul lain, khususnya molekul yang tampak serupa namun berperilaku sangat berbeda, seperti karbon dioksida (CO2). Perbedaan sifat fisik antara air dan karbon dioksida, yang secara dramatis mempengaruhi perannya di lingkungan dan dalam sistem biologis, menunjukkan betapa pentingnya pemahaman konsep polaritas molekul.
Sifat polar air (H₂O) yang memengaruhi banyak proses kehidupan, ternyata punya analogi menarik. Bayangkan kompleksitasnya seperti mempelajari jinising tembang macapat , dengan beragam aturan dan variasi irama yang rumit. Mempelajari keduanya membutuhkan ketelitian dan pemahaman mendalam, sama halnya dengan memahami bagaimana ikatan polar dalam H₂O berinteraksi dan membentuk struktur unik yang vital bagi kehidupan.
Perbedaannya? Satu bersifat kimia, satu lagi seni sastra Jawa. Namun, kompleksitas keduanya sama-sama menantang.
Polaritas H2O dan CO2
Air (H2O) merupakan molekul polar karena perbedaan elektronegativitas yang signifikan antara atom oksigen dan atom hidrogen. Oksigen, lebih elektronegatif, menarik elektron lebih kuat, menciptakan muatan parsial negatif (δ-) pada atom oksigen dan muatan parsial positif (δ+) pada atom hidrogen. Ini menghasilkan momen dipol yang signifikan, membuat molekul air memiliki kutub positif dan negatif yang jelas. Sebaliknya, karbon dioksida (CO2) adalah molekul linier dengan atom karbon di tengah dan dua atom oksigen di kedua sisinya. Meskipun ikatan C=O bersifat polar, simetrisnya molekul ini menyebabkan momen dipolnya nol, sehingga CO2 bersifat nonpolar. Ini adalah contoh klasik bagaimana geometri molekul berpengaruh pada polaritas keseluruhan.
Tabel Perbandingan Sifat Fisik H2O dan CO2
| Sifat | H2O | CO2 |
|---|---|---|
| Titik didih (°C) | 100 | -78.5 |
| Titik lebur (°C) | 0 | -56.6 |
| Kepadatan (g/cm³) pada 25°C | 0.997 | (Gas pada 25°C) |
| Kelarutan dalam air | Sangat larut | Sedikit larut |
| Tegangan permukaan | Tinggi | Rendah |
Perbedaan sifat fisik yang signifikan ini, seperti titik didih dan kelarutan, merupakan konsekuensi langsung dari perbedaan polaritas antara H2O dan CO2. Ikatan hidrogen yang kuat dalam air, akibat polaritasnya, berkontribusi pada titik didih yang tinggi dan tegangan permukaan yang tinggi.
Mengapa CO2 Nonpolar Meskipun Memiliki Ikatan Polar
Meskipun ikatan C=O dalam CO2 bersifat polar, geometri linier molekul ini menyebabkan momen dipol individual dari setiap ikatan C=O saling meniadakan. Bayangkan dua vektor gaya yang sama besar namun berlawanan arah; resultan gaya totalnya adalah nol. Hal yang sama terjadi pada momen dipol CO2. Karena momen dipol totalnya nol, molekul CO2 secara keseluruhan bersifat nonpolar.
Perbedaan polaritas antara H2O dan CO2 memiliki implikasi yang sangat besar. Polaritas air memungkinkan terjadinya ikatan hidrogen yang kuat, yang bertanggung jawab atas sifat-sifat uniknya seperti titik didih tinggi, tegangan permukaan tinggi, dan kemampuannya sebagai pelarut universal. Sebaliknya, sifat nonpolar CO2 menyebabkan titik didih rendah dan kelarutan yang rendah dalam air, membuatnya berperan penting dalam siklus karbon atmosferik namun dengan sifat yang sangat berbeda dari air.
Percobaan Kelarutan Garam dalam Air dan Pelarut Nonpolar, H2o polar atau nonpolar
Percobaan sederhana dapat dilakukan untuk membandingkan kelarutan garam (misalnya, NaCl) dalam air (pelarut polar) dan dalam pelarut nonpolar (misalnya, minyak sayur). Larutkan sejumlah garam yang sama dalam volume air dan minyak yang sama. Amati dan bandingkan seberapa banyak garam yang larut di masing-masing pelarut. Hasilnya akan menunjukkan bahwa garam, sebagai senyawa ionik, jauh lebih larut dalam air polar daripada dalam minyak nonpolar. Ini mengilustrasikan bagaimana polaritas pelarut memengaruhi kelarutan zat terlarut.
Pengaruh Polaritas terhadap Kelarutan
Air, senyawa yang begitu vital bagi kehidupan, memiliki sifat unik yang menentukan perannya dalam berbagai proses biologis dan kimiawi. Sifat unik ini berakar pada polaritas molekulnya. Polaritas air, yang disebabkan oleh perbedaan elektronegativitas antara atom oksigen dan hidrogen, memiliki implikasi yang signifikan terhadap kemampuannya melarutkan berbagai zat. Memahami bagaimana polaritas air mempengaruhi kelarutan merupakan kunci untuk mengungkap berbagai fenomena alam dan aplikasi teknologi.
Kelarutan Zat dalam Air
Polaritas air secara langsung memengaruhi kemampuannya melarutkan zat-zat tertentu. Prinsip “like dissolves like” menjelaskan fenomena ini: zat polar cenderung larut dalam pelarut polar, sementara zat nonpolar larut dalam pelarut nonpolar. Air, sebagai pelarut polar, akan dengan mudah melarutkan zat-zat polar melalui interaksi dipol-dipol atau ikatan hidrogen. Sebaliknya, zat-zat nonpolar akan sulit larut dalam air karena kurangnya interaksi yang kuat antara molekul air dan molekul zat tersebut.
- Zat yang Larut: Gula (sukrosa) adalah contoh zat polar yang larut baik dalam air. Gugus hidroksil (-OH) pada molekul sukrosa membentuk ikatan hidrogen yang kuat dengan molekul air, sehingga memungkinkan gula untuk terdispersi secara merata dalam air.
- Zat yang Tidak Larut: Minyak, sebagai zat nonpolar, tidak larut dalam air. Molekul minyak tidak mampu membentuk ikatan hidrogen dengan molekul air, sehingga terjadi pemisahan fasa antara minyak dan air.
Diagram Alir Proses Pelarutan
Proses pelarutan zat dalam air dapat divisualisasikan melalui diagram alir berikut. Proses ini menggambarkan bagaimana polaritas air berperan dalam interaksi dengan zat terlarut.
- Zat polar/nonpolar diintroduksi ke dalam air.
- Molekul air berinteraksi dengan zat terlarut.
- Jika zat terlarut polar, ikatan hidrogen atau interaksi dipol-dipol terbentuk, menyebabkan disolusi.
- Jika zat terlarut nonpolar, interaksi lemah terjadi, menyebabkan sedikit atau tidak ada disolusi.
- Zat terlarut terdispersi dalam air (jika larut).
Faktor-faktor Lain yang Mempengaruhi Kelarutan
Meskipun polaritas merupakan faktor utama yang menentukan kelarutan, beberapa faktor lain juga berperan, seperti suhu, tekanan, dan ukuran partikel zat terlarut. Suhu yang lebih tinggi umumnya meningkatkan kelarutan, karena energi kinetik yang lebih tinggi membantu mengatasi gaya antarmolekul. Tekanan juga dapat mempengaruhi kelarutan, terutama untuk gas terlarut. Ukuran partikel zat terlarut juga berpengaruh; partikel yang lebih kecil memiliki luas permukaan yang lebih besar, sehingga meningkatkan laju pelarutan.
Penerapan Prinsip “Like Dissolves Like”
Prinsip “like dissolves like” dapat diamati dalam berbagai aplikasi sehari-hari. Misalnya, pembersih berbasis air efektif menghilangkan kotoran polar seperti garam dan gula, sementara pembersih berbasis pelarut organik lebih efektif untuk menghilangkan kotoran nonpolar seperti minyak dan lemak. Hal ini menunjukkan bagaimana pemahaman tentang polaritas dan kelarutan sangat penting dalam pengembangan berbagai produk dan proses.
Penutup
Kesimpulannya, polaritas air bukanlah sekadar konsep kimia abstrak, melainkan landasan pemahaman terhadap berbagai fenomena alam dan proses kehidupan. Sifat polar H2O, dengan momen dipolnya yang signifikan dan kemampuan membentuk ikatan hidrogen, memberikannya sifat-sifat unik yang mendukung kehidupan di Bumi. Dari kemampuannya melarutkan zat hingga perannya dalam regulasi suhu, polaritas air menunjukkan betapa sebuah detail kimiawi dapat memiliki dampak yang luar biasa pada dunia di sekitar kita. Mempelajari ini membuka jalan untuk inovasi dan pemahaman yang lebih dalam mengenai alam sekitar kita.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya