Jelaskan mengapa kesetimbangan kimia disebut kesetimbangan dinamis? Pertanyaan ini menguak misteri di balik reaksi kimia yang tampak statis, namun sebenarnya bergejolak dalam skala mikroskopis. Bayangkan lautan molekul bereaksi silih berganti, produk berubah menjadi reaktan dan sebaliknya dengan kecepatan yang sama. Seolah-olah sebuah tarian molekul yang tak pernah berhenti, di mana jumlah penari tetap konstan meski mereka terus bertukar posisi. Kesetimbangan kimia, bukanlah titik akhir reaksi, melainkan kondisi dinamis di mana laju reaksi maju dan mundur sama, menciptakan ilusi keseimbangan yang sebenarnya merupakan aktivitas molekuler yang tiada henti.
Konsep kesetimbangan dinamis ini mendasari banyak fenomena alam dan proses industri. Memahami mengapa kesetimbangan kimia disebut dinamis, membuka pintu untuk mengendalikan reaksi kimia, meningkatkan efisiensi produksi, dan bahkan memahami proses-proses kehidupan yang rumit. Dari produksi pupuk hingga metabolisme di dalam tubuh kita, prinsip kesetimbangan dinamis memainkan peran krusial. Mari kita selami lebih dalam keajaiban reaksi-reaksi kimia yang tampak diam, namun sesungguhnya begitu dinamis.
Kesetimbangan Kimia: Dinamika Tersembunyi di Balik Reaksi
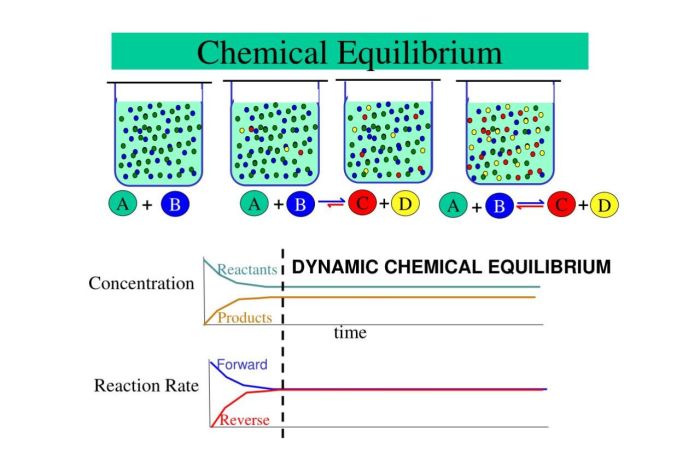
Kesetimbangan kimia, sebuah konsep fundamental dalam kimia, seringkali disalahpahami sebagai keadaan statis. Padahal, kenyataannya jauh lebih dinamis dan menarik. Ia menggambarkan sebuah kondisi di mana laju reaksi maju dan reaksi balik sama, menciptakan ilusi reaksi berhenti. Namun, pada tingkat mikroskopis, reaksi terus berlangsung secara simultan dan konstan. Memahami kesetimbangan kimia sangat krusial, tidak hanya dalam ranah akademis, tetapi juga dalam berbagai aplikasi industri, dari produksi pupuk hingga pengembangan obat-obatan. Artikel ini akan mengupas lebih dalam mengenai konsep kesetimbangan kimia, menjelaskan dinamika tersembunyi di baliknya, dan faktor-faktor yang mempengaruhinya.
Definisi Kesetimbangan Kimia
Kesetimbangan kimia adalah kondisi di mana laju reaksi maju (reaktan membentuk produk) sama dengan laju reaksi balik (produk membentuk reaktan). Pada kondisi ini, konsentrasi reaktan dan produk tetap konstan meskipun reaksi masih berlangsung. Ini bukanlah keadaan statis, melainkan keadaan dinamis di mana reaksi terus terjadi, tetapi perubahan konsentrasi bersihnya nol.
Contoh Reaksi Kesetimbangan Kimia, Jelaskan mengapa kesetimbangan kimia disebut kesetimbangan dinamis
Salah satu contoh reaksi kesetimbangan yang sederhana adalah reaksi pembentukan amonia dari nitrogen dan hidrogen: N2(g) + 3H2(g) ⇌ 2NH3(g). Reaksi ini berlangsung secara reversibel, artinya produk (amonia) dapat kembali bereaksi membentuk reaktan (nitrogen dan hidrogen).
Ilustrasi Mikroskopis Reaksi Kesetimbangan Kimia
Bayangkan sebuah wadah berisi partikel nitrogen (N2) dan hidrogen (H2) yang direpresentasikan sebagai bola-bola kecil. Pada awal reaksi, bola-bola N2 dan H2 bertabrakan dan bergabung membentuk molekul amonia (NH3), yang direpresentasikan sebagai bola-bola dengan bentuk berbeda. Namun, seiring berjalannya waktu, molekul amonia juga bertabrakan dan terurai kembali menjadi N2 dan H2. Pada kesetimbangan, laju pembentukan amonia sama dengan laju penguraian amonia. Meskipun jumlah partikel N2, H2, dan NH3 tampak konstan secara makroskopis, pada tingkat mikroskopis, partikel-partikel terus bergerak dan bereaksi secara dinamis, menciptakan pertukaran konstan antara reaktan dan produk.
Perbandingan Reaksi Irreversible dan Reaksi Reversibel
| Jenis Reaksi | Ciri-ciri | Contoh Reaksi |
|---|---|---|
| Reaksi Irreversible | Reaksi berlangsung satu arah, reaktan berubah menjadi produk secara sempurna. Tidak ada reaksi balik yang signifikan. | Pembakaran sempurna metana: CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) |
| Reaksi Reversibel (mencapai kesetimbangan) | Reaksi berlangsung dua arah, reaktan membentuk produk dan produk membentuk reaktan secara simultan. Pada kesetimbangan, laju reaksi maju sama dengan laju reaksi balik. | Pembentukan amonia: N2(g) + 3H2(g) ⇌ 2NH3(g) |
Faktor-faktor yang Mempengaruhi Kesetimbangan Kimia
Beberapa faktor eksternal dapat menggeser kesetimbangan kimia, mempercepat pembentukan produk atau reaktan. Perubahan-perubahan ini dapat diprediksi menggunakan prinsip Le Chatelier. Faktor-faktor tersebut meliputi perubahan konsentrasi reaktan atau produk, perubahan suhu, dan perubahan tekanan (khususnya untuk reaksi yang melibatkan gas).
- Perubahan Konsentrasi: Menambahkan reaktan akan menggeser kesetimbangan ke arah pembentukan produk, sedangkan menambahkan produk akan menggeser kesetimbangan ke arah pembentukan reaktan.
- Perubahan Suhu: Pengaruh suhu bergantung pada apakah reaksi tersebut eksoterm (melepaskan panas) atau endoterm (memerlukan panas). Meningkatkan suhu pada reaksi endoterm akan menggeser kesetimbangan ke arah produk, sedangkan pada reaksi eksoterm akan menggeser kesetimbangan ke arah reaktan.
- Perubahan Tekanan: Perubahan tekanan hanya berpengaruh signifikan pada reaksi yang melibatkan gas. Meningkatkan tekanan akan menggeser kesetimbangan ke arah jumlah mol gas yang lebih sedikit, sedangkan menurunkan tekanan akan menggeser kesetimbangan ke arah jumlah mol gas yang lebih banyak.
Kesetimbangan Dinamis: Jelaskan Mengapa Kesetimbangan Kimia Disebut Kesetimbangan Dinamis
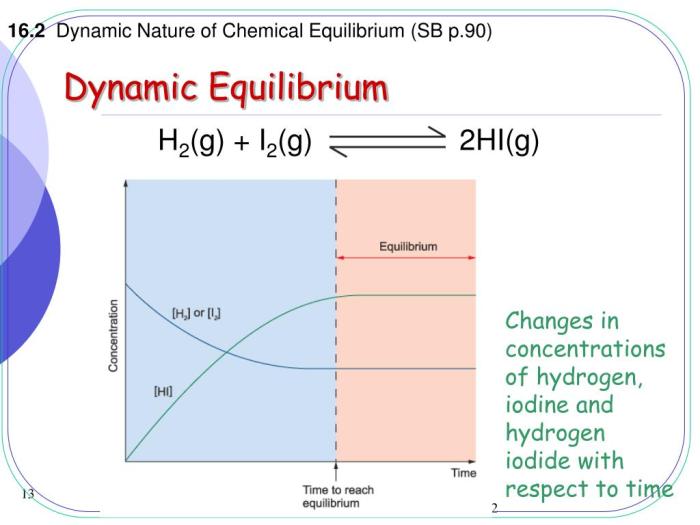
Kesetimbangan kimia, seringkali disalahpahami sebagai keadaan statis, sebenarnya merupakan proses dinamis yang terus bergerak. Bayangkan sebuah jalan raya ramai di jam sibuk; kendaraan terus bergerak, namun jumlah kendaraan yang masuk dan keluar ruas jalan tertentu cenderung seimbang. Begitu pula kesetimbangan kimia: reaksi maju dan mundur berlangsung terus menerus, namun perubahan konsentrasi reaktan dan produk secara makroskopis tampak konstan. Pemahaman mendalam tentang kesetimbangan dinamis ini krusial dalam berbagai bidang, dari pengembangan obat hingga optimasi proses industri. Artikel ini akan mengupas lebih dalam tentang konsep laju reaksi maju dan mundur sebagai jantung dari kesetimbangan dinamis.
Laju Reaksi Maju dan Mundur dalam Kesetimbangan Kimia
Pada reaksi reversibel, reaksi maju (reaktan membentuk produk) dan reaksi mundur (produk membentuk reaktan) terjadi secara simultan. Laju reaksi maju didefinisikan sebagai kecepatan berkurangnya konsentrasi reaktan per satuan waktu, sementara laju reaksi mundur adalah kecepatan berkurangnya konsentrasi produk per satuan waktu. Pada keadaan kesetimbangan, kedua laju reaksi ini sama besar, meskipun reaksi maju dan mundur tetap berlangsung.
Ilustrasi Kesetimbangan dan Sistem Belum Seimbang
Bayangkan dua wadah. Wadah A berisi gas nitrogen dioksida (NO2) berwarna cokelat kemerahan dan gas dinitrogen tetraoksida (N2O4) yang tidak berwarna. Awalnya, laju pembentukan N2O4 (reaksi maju) jauh lebih cepat daripada penguraiannya kembali menjadi NO2 (reaksi mundur). Warna cokelat kemerahan akan tampak semakin pudar seiring waktu. Sebaliknya, di wadah B, sistem telah mencapai kesetimbangan. Warna cokelat kemerahan tetap konstan karena laju pembentukan dan penguraian NO2 sama. Wadah A menggambarkan sistem yang belum mencapai kesetimbangan, sementara wadah B menggambarkan sistem dalam kesetimbangan dinamis.
Contoh Numerik Kesetimbangan
Misalnya, perhatikan reaksi sederhana A ⇌ B. Pada kesetimbangan, jika laju reaksi maju adalah 0,05 mol/L.s dan laju reaksi mundur juga 0,05 mol/L.s, maka sistem berada dalam kesetimbangan. Perubahan konsentrasi A dan B secara makroskopis tidak teramati, meskipun reaksi terus berlangsung.
Kesetimbangan kimia disebut dinamis karena reaksi maju dan balik berlangsung terus-menerus dengan laju yang sama, sehingga konsentrasi reaktan dan produk tetap konstan. Analogi sederhana: bayangkan pernapasan kita; prosesnya tak pernah berhenti, ibarat reaksi bolak-balik. Ketika berolahraga, kebutuhan oksigen meningkat drastis, memaksa kita bernapas lebih dalam—seperti penjelasan detail di mengapa kamu harus bernapas lebih dalam ketika sedang berolahraga —untuk menjaga keseimbangan oksigen dan karbon dioksida dalam tubuh.
Kembali ke kesetimbangan kimia, perubahan kondisi eksternal, seperti olahraga yang meningkatkan kebutuhan oksigen, akan menggeser kesetimbangan, tetapi reaksi maju-balik tetap berlangsung untuk mencapai kesetimbangan baru.
Perbandingan Kesetimbangan Statis dan Dinamis
- Kesetimbangan Statis: Reaksi berhenti sepenuhnya; tidak ada reaksi maju maupun mundur yang terjadi. Mirip seperti mesin yang mati total.
- Kesetimbangan Dinamis: Reaksi maju dan mundur terus berlangsung dengan laju yang sama; perubahan konsentrasi reaktan dan produk secara makroskopis konstan. Analogi seperti jalan raya yang ramai: kendaraan terus bergerak, namun jumlah kendaraan yang masuk dan keluar tetap seimbang.
Skenario Reaksi Kesetimbangan
Perhatikan reaksi pembentukan ester dari asam karboksilat dan alkohol. Meskipun konsentrasi ester dan air tampak konstan secara makroskopis pada kesetimbangan, molekul-molekul asam karboksilat dan alkohol terus bereaksi membentuk ester dan air, sementara molekul-molekul ester dan air juga terus bereaksi membentuk asam karboksilat dan alkohol. Ini menunjukkan bahwa kesetimbangan merupakan keadaan dinamis, bukan statis.
Bukti Kesetimbangan Dinamis
Kesetimbangan kimia, seringkali disalahpahami sebagai keadaan statis, sebenarnya merupakan proses dinamis yang melibatkan reaksi maju dan balik yang berlangsung secara simultan. Memahami sifat dinamis ini krusial untuk menguasai konsep inti kimia dan aplikasinya di berbagai bidang, dari industri hingga lingkungan. Bukti-bukti eksperimental yang kuat mendukung pemahaman ini, menunjukkan bahwa reaksi tidak berhenti pada saat kesetimbangan tercapai, melainkan terus berlangsung dengan laju yang sama. Penjelasan berikut akan mengungkap beberapa bukti empiris yang memperkuat konsep kesetimbangan dinamis.
Konsep kesetimbangan dinamis menjelaskan bahwa pada keadaan kesetimbangan, reaksi maju dan reaksi balik berlangsung dengan kecepatan yang sama. Ini berarti jumlah produk dan reaktan tetap konstan, meskipun reaksi terus terjadi. Perlu dipahami bahwa kesetimbangan bukanlah titik akhir reaksi, melainkan suatu keadaan di mana perubahan makroskopis tidak lagi teramati. Berbagai eksperimen dirancang untuk mengungkap sifat dinamis ini, membuktikan bahwa kesetimbangan bukanlah keadaan statis yang tak berubah.
Kesetimbangan kimia disebut dinamis karena reaksi maju dan balik tetap berlangsung secara simultan, meskipun laju keduanya sama sehingga konsentrasi reaktan dan produk konstan. Bayangkan proses ini seperti arus lalu lintas di sekitar kampus salah satu universitas terkenal yang ada di Afrika berada di , kendaraan terus bergerak, namun jumlah kendaraan yang masuk dan keluar area kampus tetap seimbang.
Analogi ini menggambarkan bagaimana, dalam kesetimbangan kimia, meskipun reaksi terus terjadi, tidak ada perubahan bersih dalam komposisi sistem secara keseluruhan. Ini kunci pemahaman mendasar kesetimbangan dinamis.
Eksperimen Pembuktian Kesetimbangan Dinamis
Suatu eksperimen sederhana dapat dilakukan untuk mendemonstrasikan sifat dinamis kesetimbangan kimia. Misalnya, perhatikan reaksi antara ion besi(III) dan ion tiosianat yang membentuk ion kompleks berwarna merah darah, [Fe(SCN)]2+. Dengan mengontrol konsentrasi reaktan, kita dapat mengamati perubahan warna yang menunjukkan pergeseran kesetimbangan.
- Siapkan dua larutan: satu berisi ion besi(III) dan yang lain berisi ion tiosianat. Kedua larutan ini harus memiliki konsentrasi yang cukup untuk menghasilkan warna yang terlihat jelas saat dicampur.
- Campurkan kedua larutan tersebut dalam sebuah wadah bening. Warna merah darah dari ion kompleks [Fe(SCN)]2+ akan terbentuk.
- Bagi larutan tersebut menjadi dua bagian yang sama. Pada salah satu bagian, tambahkan sejumlah kecil ion besi(III) tambahan. Pada bagian lainnya, tambahkan sejumlah kecil ion tiosianat tambahan.
- Amati perubahan warna pada kedua bagian larutan. Penambahan reaktan akan menggeser kesetimbangan, menyebabkan perubahan intensitas warna yang menunjukkan reaksi maju dan balik yang terus berlangsung.
Perubahan warna yang diamati pada eksperimen ini menunjukkan bahwa reaksi maju dan balik terus terjadi, bahkan setelah kesetimbangan tercapai. Penambahan reaktan menyebabkan pergeseran kesetimbangan, yang terlihat sebagai perubahan warna. Ini menjadi bukti kuat bahwa kesetimbangan kimia bersifat dinamis, bukan statis.
Kesetimbangan kimia disebut dinamis karena reaksi maju dan balik terus berlangsung secara simultan, laju reaksi yang sama menjaga konsentrasi tetap konstan. Bayangkan seperti perpindahan kalor, prosesnya terus terjadi, sebagaimana dijelaskan dalam artikel mengapa kalor dapat berpindah , panas mengalir dari suhu tinggi ke rendah hingga tercapai kesetimbangan termal. Analogi ini membantu memahami mengapa, meski tampak statis, kesetimbangan kimia sebenarnya merupakan proses dinamis yang tak pernah berhenti.
Diagram Alir Eksperimen
Berikut diagram alir sederhana yang menggambarkan prosedur eksperimen tersebut:
- Siapkan larutan Fe3+ dan SCN–
- Campur kedua larutan, amati pembentukan [Fe(SCN)]2+ (warna merah)
- Bagi larutan menjadi dua bagian
- Tambahkan Fe3+ pada bagian pertama, amati perubahan warna
- Tambahkan SCN– pada bagian kedua, amati perubahan warna
- Kesimpulan: Perubahan warna menunjukkan kesetimbangan dinamis
Penggunaan Isotop untuk Membuktikan Kesetimbangan Dinamis
Penggunaan isotop, seperti 14C atau 15N, memberikan bukti yang lebih kuat lagi. Dengan melacak pergerakan isotop ini selama reaksi, kita dapat melihat bahwa bahkan setelah kesetimbangan tercapai, atom-atom terus bertukar tempat antara reaktan dan produk. Misalnya, jika kita menambahkan isotop 15N ke dalam amonia (NH3) dalam reaksi pembentukan amonia dari nitrogen dan hidrogen, kita akan mendeteksi 15N baik dalam amonia maupun nitrogen setelah kesetimbangan tercapai. Hal ini menunjukkan bahwa reaksi maju dan balik terus berlangsung, meskipun secara makroskopis tidak terlihat perubahan.
Kutipan dari Sumber Ilmiah
“The dynamic nature of chemical equilibrium is evidenced by the continuous exchange of atoms between reactants and products, even when the macroscopic properties of the system remain constant.” – (Sumber: Buku teks kimia tingkat universitas, nama penulis dan judul buku dapat digantikan dengan sumber yang relevan).
Penerapan Konsep Kesetimbangan Dinamis

Kesetimbangan dinamis, jauh dari sekadar konsep abstrak dalam buku kimia, merupakan fenomena yang menentukan berbagai proses, dari reaksi sederhana di laboratorium hingga mekanisme kompleks kehidupan. Ia menggambarkan suatu keadaan di mana laju reaksi maju dan reaksi balik sama, menciptakan kestabilan yang tampak, meski pada kenyataannya reaksi terus berlangsung. Memahami penerapannya sangat krusial, baik untuk memperbaiki efisiensi industri maupun untuk mengapresiasi kecanggihan proses biologis dalam tubuh kita.
Kesetimbangan Dinamis dalam Kehidupan Sehari-hari
Konsep kesetimbangan dinamis berperan dalam banyak aspek kehidupan sehari-hari, seringkali tanpa kita sadari. Misalnya, larutan garam dalam air mencapai kesetimbangan di mana garam terus larut dan mengendap dengan laju yang sama. Proses melarutkan gula dalam kopi juga menunjukkan kesetimbangan dinamis. Meskipun gula tampak larut sempurna, sebenarnya terjadi pertukaran molekul gula antara fase terlarut dan fase padat (jika ada gula yang belum larut). Begitu pula, karbon dioksida dalam minuman bersoda berada dalam kesetimbangan dinamis antara fase gas dan fase terlarut. Saat kita membuka botol, tekanan berkurang, dan kesetimbangan bergeser, mengakibatkan gelembung gas karbon dioksida keluar.
Penerapan Kesetimbangan Dinamis dalam Industri
Industri berbagai sektor memanfaatkan prinsip kesetimbangan dinamis untuk meningkatkan efisiensi produksi. Industri pupuk, misalnya, memanfaatkan reaksi sintesis amonia (proses Haber-Bosch) yang sangat bergantung pada pengaturan kondisi untuk mendapatkan hasil optimal. Pengaturan suhu, tekanan, dan konsentrasi reaktan dilakukan untuk menggeser kesetimbangan menuju pembentukan amonia sebanyak mungkin. Demikian pula, industri petrokimia memanfaatkan prinsip ini dalam proses pembuatan berbagai senyawa dari hidrokarbon. Optimasi kondisi reaksi menjadi kunci untuk mendapatkan produk yang diinginkan dengan efisiensi tinggi dan meminimalkan limbah.
Peran Kesetimbangan Dinamis dalam Proses Biologis
Di dalam tubuh makhluk hidup, keseimbangan dinamis berperan sangat penting dalam mempertahankan homeostasis. Contohnya, keseimbangan asam basa dalam darah diatur melalui sistem buffer yang melibatkan reaksi-reaksi yang berada dalam keadaan kesetimbangan dinamis. Sistem ini menjaga pH darah tetap stabil meskipun terjadi perubahan konsentrasi asam atau basa. Proses pengikatan oksigen oleh hemoglobin dalam darah juga merupakan contoh keseimbangan dinamis. Oksigen berikatan dan terlepas dari hemoglobin secara terus-menerus, menyesuaikan dengan perubahan tekanan parsial oksigen.
Contoh Kasus: Pengaruh Perubahan Kondisi terhadap Kesetimbangan Dinamis
Reaksi pembentukan gas hidrogen iodida (HI) dari hidrogen (H₂) dan iodin (I₂) merupakan reaksi reversibel: H₂(g) + I₂(g) ⇌ 2HI(g). Jika kita menambahkan lebih banyak H₂, keseimbangan akan bergeser ke kanan, meningkatkan jumlah HI yang terbentuk. Sebaliknya, pengurangan konsentrasi HI akan menggeser kesetimbangan ke kanan untuk membentuk lebih banyak HI. Meningkatkan suhu reaksi eksotermis ini akan menggeser kesetimbangan ke kiri, mengurangi jumlah HI.
Dampak Perubahan Suhu terhadap Kesetimbangan Dinamis
Perubahan suhu mempengaruhi kesetimbangan dinamis melalui perubahan konstanta kesetimbangan (Kc). Untuk reaksi eksotermis (melepaskan panas), peningkatan suhu akan menggeser kesetimbangan ke arah reaktan, mengurangi jumlah produk. Sebaliknya, penurunan suhu akan menggeser kesetimbangan ke arah produk. Untuk reaksi endotermis (memerlukan panas), peningkatan suhu akan menggeser kesetimbangan ke arah produk, meningkatkan jumlah produk. Penurunan suhu akan memiliki efek sebaliknya. Pengaruh ini dapat diprediksi dan dimanipulasi untuk mengoperasikan reaksi dengan efisiensi optimal, seperti yang dilakukan dalam berbagai proses industri.
Ringkasan Terakhir
Kesimpulannya, kesetimbangan kimia, meskipun tampak statis dari perspektif makroskopis, merupakan proses dinamis yang penuh aktivitas di tingkat molekul. Laju reaksi maju dan mundur yang sama menciptakan ilusi keseimbangan, sementara reaksi terus berlangsung tanpa henti. Pemahaman mendalam tentang kesetimbangan dinamis ini membuka peluang luas dalam berbagai bidang, dari industri hingga biologi. Dengan menguasai prinsip-prinsip ini, kita dapat memanipulasi reaksi kimia untuk menghasilkan produk yang diinginkan dengan efisiensi optimal, dan bahkan mengungkap rahasia proses-proses kehidupan yang menakjubkan.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya