Mengapa senyawa kovalen juga merupakan larutan elektrolit? Pertanyaan ini mungkin terdengar paradoksal, mengingat senyawa kovalen umumnya dikenal sebagai isolator listrik. Namun, kenyataannya beberapa senyawa kovalen tertentu mampu menghantarkan arus listrik ketika dilarutkan dalam air. Fenomena ini membuka jendela baru dalam pemahaman kita tentang sifat listrik materi, melampaui konsep sederhana ikatan ionik dan kovalen. Lebih jauh lagi, memahami perilaku ini crucial dalam berbagai aplikasi, mulai dari industri hingga teknologi mutakhir. Mari kita telusuri lebih dalam misteri di balik kemampuan senyawa kovalen untuk menjadi elektrolit.
Senyawa kovalen, yang terbentuk dari pemakaian bersama elektron antar atom, umumnya tidak menghantarkan listrik dalam bentuk murni. Sebaliknya, elektrolit, baik itu senyawa ionik atau kovalen tertentu, menghasilkan ion-ion bermuatan ketika dilarutkan, memungkinkan aliran listrik. Kunci perbedaan ini terletak pada kemampuan senyawa untuk terionisasi dalam larutan. Beberapa senyawa kovalen, khususnya yang polar, dapat bereaksi dengan air membentuk ion-ion, sehingga mampu menghantarkan arus listrik. Proses ionisasi ini bergantung pada beberapa faktor, termasuk polaritas molekul, kekuatan ikatan, dan sifat pelarut.
Senyawa Kovalen dan Sifat Elektrolitnya: Sebuah Tinjauan: Mengapa Senyawa Kovalen Juga Merupakan Larutan Elektrolit
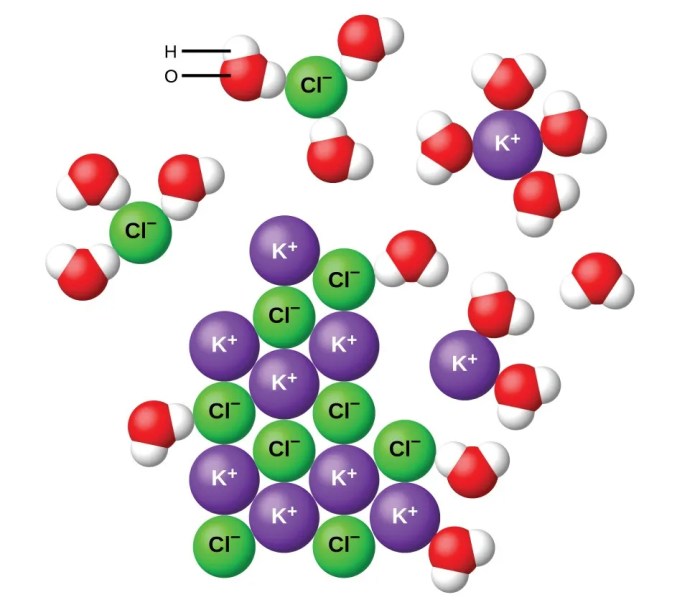
Kita seringkali mendengar istilah senyawa kovalen dan elektrolit dalam konteks kimia. Namun, pemahaman yang mendalam tentang keduanya, khususnya bagaimana senyawa kovalen bisa berperan sebagai elektrolit, seringkali kurang dipahami. Artikel ini akan mengupas tuntas definisi, perbedaan, dan bagaimana beberapa senyawa kovalen dapat menghantarkan listrik, suatu sifat yang biasanya diasosiasikan dengan elektrolit.
Senyawa kovalen, meski ikatannya tak melibatkan ion, bisa jadi larutan elektrolit. Ini terjadi karena beberapa senyawa kovalen, saat terlarut dalam air, mengalami ionisasi, melepaskan ion-ion yang menghantarkan listrik. Fenomena ini mungkin tampak paradoksal, selayaknya pertanyaan mengapa Indonesia hanya mengalami dua musim, mengapa indonesia hanya mengalami dua musim , yang sebenarnya lebih kompleks daripada sekadar pembagian musim hujan dan kemarau.
Kembali ke senyawa kovalen, ionisasi ini bergantung pada polaritas molekul dan kemampuannya berinteraksi dengan pelarut. Intinya, konduktivitas listrik larutannya ditentukan oleh keberadaan ion-ion yang dihasilkan, bukan semata-mata jenis ikatan kimianya.
Definisi Senyawa Kovalen dan Contohnya, Mengapa senyawa kovalen juga merupakan larutan elektrolit
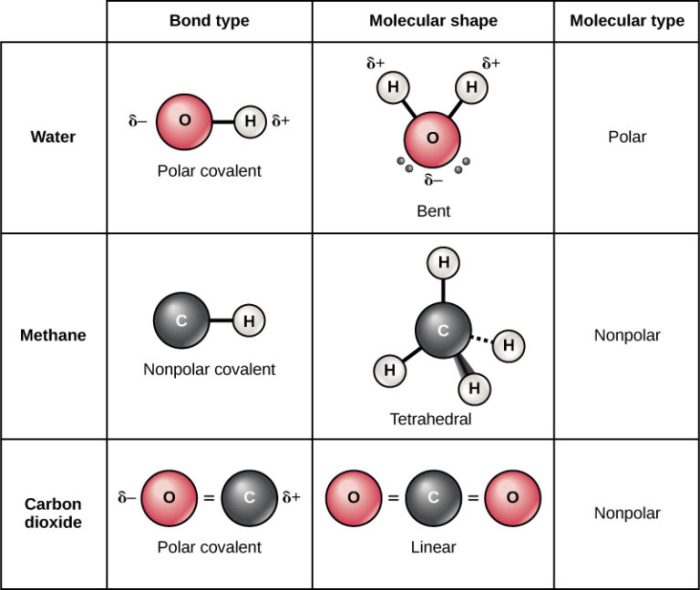
Senyawa kovalen terbentuk melalui pemakaian bersama pasangan elektron antara dua atom non-logam. Ikatan ini relatif lemah dibandingkan ikatan ionik, sehingga senyawa kovalen umumnya memiliki titik leleh dan titik didih yang lebih rendah. Contoh senyawa kovalen yang umum antara lain air (H₂O), metana (CH₄), dan karbondioksida (CO₂). Kemampuan senyawa kovalen untuk menghantarkan listrik sangat bergantung pada kemampuannya terionisasi dalam larutan.
Definisi Larutan Elektrolit dan Contohnya
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Kemampuan menghantarkan listrik ini disebabkan oleh adanya ion-ion bebas yang bergerak dalam larutan. Ion-ion ini dihasilkan dari proses disosiasi atau ionisasi senyawa ketika dilarutkan dalam pelarut, biasanya air. Garam dapur (NaCl) yang terlarut dalam air merupakan contoh klasik larutan elektrolit. Ketika NaCl larut, ia terurai menjadi ion Na⁺ dan Cl⁻ yang bebas bergerak, sehingga memungkinkan arus listrik mengalir.
Senyawa kovalen, yang umumnya dikenal sebagai non-elektrolit, bisa menjadi larutan elektrolit jika mengalami ionisasi dalam pelarut. Proses ini menghasilkan ion-ion bermuatan yang mampu menghantarkan arus listrik. Hal ini mengingatkan kita pada tenggat waktu administratif lain, seperti misalnya batas akhir verval ijazah yang juga perlu diperhatikan dengan cermat. Kembali ke senyawa kovalen, ionisasi ini seringkali dipengaruhi oleh kekuatan ikatan dan polaritas molekul, sehingga kemampuan menghantarkan listriknya bervariasi.
Intinya, kemampuan menghantarkan listrik bukanlah sifat mutlak, melainkan tergantung pada kondisi dan jenis senyawa kovalennya.
Perbandingan Konduktivitas Listrik Senyawa Kovalen dan Elektrolit
Perbedaan mendasar antara senyawa kovalen dan elektrolit terletak pada kemampuannya menghantarkan listrik. Elektrolit, karena adanya ion-ion bebas, merupakan konduktor listrik yang baik, baik dalam bentuk leburan maupun larutan. Sebaliknya, senyawa kovalen murni umumnya merupakan isolator listrik karena tidak memiliki ion-ion bebas untuk membawa muatan listrik. Namun, perlu diingat bahwa beberapa senyawa kovalen polar dapat terionisasi sebagian dalam larutan, sehingga menunjukkan konduktivitas listrik yang lemah, menjadikannya elektrolit lemah.
Tabel Perbandingan Sifat Senyawa Kovalen dan Elektrolit
| Jenis Ikatan | Konduktivitas Listrik | Contoh Senyawa |
|---|---|---|
| Kovalen | Buruk (kecuali elektrolit lemah) | Air (H₂O), Metana (CH₄), Glukosa (C₆H₁₂O₆) |
| Ionik | Baik (dalam bentuk leburan atau larutan) | Natrium klorida (NaCl), Kalium klorida (KCl) |
Ilustrasi Perbedaan Ikatan Kovalen dan Ionik
Bayangkan ikatan ionik seperti hubungan yang kuat dan kaku antara dua individu yang saling memberikan dan menerima sesuatu secara total. Ion positif dan negatif terikat erat oleh gaya elektrostatik yang kuat. Sebaliknya, ikatan kovalen lebih mirip dengan kerja sama yang erat, di mana kedua atom berbagi sumber daya (elektron) secara bersama. Dalam konteks kelistrikan, ikatan ionik yang kuat dan transfer elektron lengkap menghasilkan ion-ion bebas yang dapat menghantarkan listrik. Sementara itu, dalam ikatan kovalen, elektron terikat kuat pada atom, sehingga mobilitasnya terbatas dan konduktivitas listrik rendah. Namun, dalam kasus senyawa kovalen polar yang terionisasi sebagian, terjadi pemisahan muatan parsial yang memungkinkan sedikit konduktivitas listrik.
Kondisi Senyawa Kovalen yang Menjadi Elektrolit
Senyawa kovalen, yang umumnya dikenal sebagai senyawa yang tidak menghantarkan listrik, ternyata dapat menunjukkan sifat elektrolit dalam kondisi tertentu. Fenomena ini mungkin tampak kontradiktif, namun pemahaman mendalam tentang ikatan kimia dan interaksi antarmolekul akan mengungkap mekanisme di baliknya. Kemampuan senyawa kovalen untuk menghantarkan arus listrik merupakan area yang menarik dalam kimia, menawarkan wawasan tentang perilaku materi pada tingkat molekuler dan aplikasinya dalam berbagai bidang teknologi.
Kondisi Khusus Senyawa Kovalen yang Menunjukkan Sifat Elektrolit
Tidak semua senyawa kovalen mampu menghantarkan listrik. Kemampuan ini bergantung pada beberapa faktor kunci, termasuk polaritas ikatan, kemampuan untuk terionisasi, dan kekuatan interaksi antarmolekul dalam larutan. Senyawa kovalen polar, dengan distribusi muatan yang tidak merata, lebih mungkin terionisasi dan menjadi elektrolit dibandingkan senyawa kovalen nonpolar. Proses ionisasi sendiri membutuhkan energi, dan energi ini bisa berasal dari pelarut atau dari reaksi kimia.
Mekanisme Penghantaran Listrik pada Senyawa Kovalen Elektrolit
Penghantaran listrik pada senyawa kovalen elektrolit terjadi melalui keberadaan ion-ion bermuatan dalam larutan. Berbeda dengan senyawa ionik yang terdisosiasi langsung menjadi ion dalam air, senyawa kovalen elektrolit umumnya mengalami proses ionisasi atau autoionisasi. Proses ini menghasilkan ion-ion yang kemudian bergerak bebas dalam larutan, memungkinkan aliran muatan listrik. Kecepatan pergerakan ion ini, yang dipengaruhi oleh viskositas pelarut dan kekuatan medan listrik, menentukan daya hantar listrik larutan.
Contoh Senyawa Kovalen Elektrolit dan Penjelasannya
Asam kuat seperti HCl (asam klorida) merupakan contoh klasik senyawa kovalen yang bersifat elektrolit kuat. Dalam air, molekul HCl terionisasi sempurna menjadi ion H+ dan Cl–, menghasilkan larutan yang sangat konduktif. Hal ini disebabkan oleh polaritas ikatan H-Cl yang tinggi dan afinitas elektron klor yang kuat. Contoh lain adalah asam sulfat (H2SO4) dan asam nitrat (HNO3). Perbedaan kekuatan asam tercermin dalam derajat ionisasinya dalam larutan; asam kuat terionisasi sempurna, sedangkan asam lemah hanya terionisasi sebagian. Air (H2O) sendiri, meskipun secara umum dianggap sebagai pelarut, juga mengalami autoionisasi, menghasilkan ion H+ dan OH– dalam jumlah kecil, yang memberikan sedikit daya hantar listrik.
Poin-Poin Penting Terionisasinya Senyawa Kovalen dalam Larutan
- Kehadiran ikatan kovalen polar: Perbedaan elektronegativitas atom-atom dalam molekul menciptakan distribusi muatan yang tidak merata, meningkatkan kecenderungan untuk terionisasi.
- Interaksi dengan pelarut: Pelarut polar seperti air dapat menstabilkan ion-ion yang terbentuk setelah ionisasi, mendorong proses tersebut berlangsung.
- Kekuatan ikatan kovalen: Ikatan kovalen yang relatif lemah lebih mudah terputus, memungkinkan pembentukan ion.
- Reaksi kimia: Beberapa senyawa kovalen dapat terionisasi melalui reaksi kimia dengan pelarut atau zat lain.
Syarat utama senyawa kovalen agar dapat menghantarkan arus listrik adalah adanya kemampuan untuk terionisasi dalam larutan, menghasilkan ion-ion bermuatan yang bergerak bebas dan membawa muatan listrik. Kemampuan terionisasi ini dipengaruhi oleh polaritas molekul, interaksi dengan pelarut, dan kekuatan ikatan kovalen.
Senyawa Kovalen yang Merupakan Elektrolit
Umumnya, senyawa kovalen dikenal sebagai non-elektrolit, artinya mereka tidak menghantarkan listrik dalam larutan. Namun, kenyataannya beberapa senyawa kovalen tertentu dapat terionisasi dalam air dan membentuk ion-ion bermuatan, sehingga mampu menghantarkan arus listrik. Fenomena ini menarik untuk dikaji lebih dalam, mengingat pemahaman ini krusial dalam berbagai aplikasi kimia, mulai dari baterai hingga proses elektrokimia lainnya. Memahami jenis-jenis senyawa kovalen yang bersifat elektrolit, faktor-faktor yang mempengaruhinya, serta perbedaan perilaku mereka akan membuka wawasan baru tentang sifat-sifat senyawa kovalen.
Klasifikasi Senyawa Kovalen Berdasarkan Kemampuan Menghantarkan Listrik
Senyawa kovalen dapat diklasifikasikan menjadi elektrolit dan non-elektrolit berdasarkan kemampuannya menghantarkan arus listrik ketika dilarutkan dalam air. Elektrolit kovalen adalah senyawa kovalen yang terionisasi sebagian atau seluruhnya dalam air, menghasilkan ion-ion yang dapat menghantarkan listrik. Sebaliknya, non-elektrolit kovalen tidak terionisasi dalam air, sehingga larutannya tidak menghantarkan listrik. Perbedaan ini bergantung pada polaritas ikatan dan kekuatan interaksi antara molekul senyawa kovalen dengan molekul air.
Contoh Senyawa Kovalen Polar dan Nonpolar yang Termasuk Elektrolit
Meskipun jarang, beberapa senyawa kovalen polar dapat bersifat elektrolit. Ini terjadi karena polaritas ikatan memungkinkan molekul air untuk berinteraksi kuat dengan molekul senyawa tersebut, memisahkannya menjadi ion-ion. Contohnya adalah asam kuat seperti asam klorida (HCl) dan asam nitrat (HNO3). Asam-asam ini terionisasi sempurna dalam air, menghasilkan ion H+ dan anion yang sesuai, sehingga larutannya menjadi konduktor listrik yang baik. Sebaliknya, senyawa kovalen nonpolar umumnya merupakan non-elektrolit karena tidak memiliki kutub yang signifikan untuk berinteraksi dengan air dan terionisasi.
Senyawa kovalen, meski ikatannya tak sekuat ionik, bisa menjadi larutan elektrolit jika mengalami ionisasi dalam pelarut. Proses ini menghasilkan ion-ion bermuatan yang mampu menghantarkan listrik. Analogi sederhana: pemahaman kita tentang sains berkembang seiring waktu, layaknya sebuah kitab yang disempurnakan. Begitu pula Al-Quran, yang disebut sebagai kitab penyempurna dari kitab-kitab sebelumnya, sebagaimana dijelaskan dalam mengapa alquran disebut kitab penyempurna dari kitab-kitab sebelumnya , menawarkan pemahaman yang lebih komprehensif.
Kembali ke senyawa kovalen, kemampuannya menghantarkan listrik bergantung pada derajat ionisasinya; semakin banyak ion yang terbentuk, semakin baik daya hantarnya. Singkatnya, konsep penyempurnaan ini, baik dalam konteks keagamaan maupun sains, menunjukkan evolusi pemahaman menuju kebenaran yang lebih utuh.
Perbedaan Perilaku Senyawa Kovalen Polar dan Nonpolar dalam Larutan
Perbedaan utama terletak pada kemampuannya berinteraksi dengan pelarut polar seperti air. Senyawa kovalen polar, dengan distribusi muatan yang tidak merata, dapat berinteraksi kuat dengan molekul air melalui ikatan hidrogen atau dipol-dipol. Interaksi ini dapat memicu ionisasi sebagian atau sempurna, menghasilkan ion-ion yang menghantarkan listrik. Sebaliknya, senyawa kovalen nonpolar, dengan distribusi muatan yang merata, memiliki interaksi yang lemah dengan air, sehingga cenderung tetap sebagai molekul netral dan tidak menghantarkan listrik. Ini menjelaskan mengapa senyawa kovalen polar cenderung menjadi elektrolit, sementara senyawa kovalen nonpolar umumnya non-elektrolit.
Perbandingan Senyawa Kovalen Elektrolit dan Non-Elektrolit
| Senyawa | Jenis Ikatan | Elektrolit/Non-elektrolit | Alasan |
|---|---|---|---|
| HCl | Kovalen Polar | Elektrolit | Terionisasi sempurna dalam air menjadi H+ dan Cl- |
| HNO3 | Kovalen Polar | Elektrolit | Terionisasi sempurna dalam air menjadi H+ dan NO3- |
| CH4 (Metana) | Kovalen Nonpolar | Non-elektrolit | Tidak terionisasi dalam air |
| C6H12O6 (Glukosa) | Kovalen Polar | Non-elektrolit | Meskipun polar, tidak terionisasi dalam air |
Faktor-faktor yang Mempengaruhi Kemampuan Senyawa Kovalen Menjadi Elektrolit
Beberapa faktor kunci menentukan apakah senyawa kovalen akan bertindak sebagai elektrolit. Polaritas molekul merupakan faktor utama; molekul polar dengan perbedaan elektronegativitas yang signifikan antara atom-atomnya lebih cenderung terionisasi dalam pelarut polar seperti air. Kekuatan ikatan juga berperan; ikatan kovalen yang lemah lebih mudah putus dan membentuk ion. Selain itu, kekuatan interaksi antara molekul senyawa kovalen dan molekul air juga mempengaruhi tingkat ionisasi. Semakin kuat interaksi, semakin besar kemungkinan senyawa kovalen tersebut menjadi elektrolit. Faktor-faktor ini saling terkait dan menentukan perilaku senyawa kovalen dalam larutan.
Penerapan Senyawa Kovalen Elektrolit
Senyawa kovalen, yang umumnya dikenal sebagai senyawa non-elektrolit, ternyata menyimpan kejutan. Beberapa di antaranya mampu menghantarkan arus listrik dalam larutan, membuka pintu bagi beragam aplikasi penting dalam kehidupan sehari-hari dan industri. Kemampuan konduktivitas listrik ini tergantung pada kemampuan senyawa tersebut untuk terionisasi dalam larutan, menghasilkan ion-ion bermuatan yang berperan sebagai pembawa arus. Memahami sifat kelistrikan senyawa kovalen ini krusial untuk mengoptimalkan penggunaannya dalam berbagai bidang.
Penerapan Senyawa Kovalen Elektrolit dalam Kehidupan Sehari-hari
Senyawa kovalen elektrolit hadir dalam berbagai produk yang kita gunakan setiap hari, seringkali tanpa kita sadari. Kehadirannya memberikan fungsi spesifik yang meningkatkan kualitas dan efektivitas produk tersebut. Peran senyawa ini terkadang tersembunyi di balik formula kimia kompleks, namun dampaknya nyata dan signifikan.
- Asam asetat (CH3COOH) dalam cuka: Asam asetat, meskipun merupakan senyawa kovalen, terionisasi sebagian dalam air, menghasilkan ion-ion yang memungkinkan cuka menghantarkan arus listrik, meskipun lemah. Kemampuan ini, meskipun kecil, berperan dalam proses pengawetan makanan.
- Asam klorida (HCl) dalam pembersih: Asam klorida encer digunakan dalam beberapa pembersih rumah tangga. Ion H+ dan Cl– yang dihasilkan saat terionisasi dalam air membantu dalam proses pembersihan dengan cara melarutkan kotoran dan noda.
- Air laut: Meskipun dominan mengandung garam anorganik (elektrolit ionik), air laut juga mengandung senyawa kovalen yang terionisasi, berkontribusi pada konduktivitas listriknya yang memungkinkan kehidupan laut dan aplikasi teknologi seperti desalination.
Peran Senyawa Kovalen Elektrolit dalam Berbagai Industri
Di sektor industri, senyawa kovalen elektrolit memainkan peran yang jauh lebih signifikan, mendukung proses-proses vital dalam berbagai sektor manufaktur dan teknologi. Penggunaan yang tepat dan terkontrol dari senyawa ini menentukan efisiensi dan kualitas produk akhir.
- Industri baterai: Beberapa baterai menggunakan senyawa kovalen elektrolit dalam elektrolitnya untuk memfasilitasi perpindahan ion dan menghasilkan arus listrik. Contohnya adalah baterai lithium-ion yang menggunakan garam lithium dalam pelarut organik.
- Industri kimia: Senyawa kovalen elektrolit berperan sebagai katalis atau reaktan dalam berbagai reaksi kimia industri, meningkatkan efisiensi dan mengurangi limbah. Proses elektrolisis juga seringkali memanfaatkan senyawa ini.
- Industri farmasi: Beberapa senyawa kovalen elektrolit digunakan dalam formulasi obat-obatan, baik sebagai zat aktif maupun sebagai eksipien (bahan tambahan). Sifat kelistrikannya dapat mempengaruhi bioavailabilitas dan efektivitas obat.
Contoh Reaksi Kimia yang Melibatkan Senyawa Kovalen Elektrolit
Reaksi kimia yang melibatkan senyawa kovalen elektrolit seringkali melibatkan proses ionisasi dan reaksi redoks. Pemahaman terhadap reaksi ini penting untuk mengontrol dan mengoptimalkan proses industri.
Contoh: Reaksi ionisasi asam asetat dalam air: CH3COOH + H2O ⇌ CH3COO– + H3O+. Ion-ion yang dihasilkan (asetat dan hidronium) memungkinkan larutan asam asetat menghantarkan arus listrik.
Peran Senyawa Kovalen Elektrolit dalam Proses Tertentu
Senyawa kovalen elektrolit berperan dalam berbagai proses, baik secara langsung maupun tidak langsung. Peran ini seringkali menentukan efisiensi dan keberhasilan proses tersebut.
| Proses | Peran Senyawa Kovalen Elektrolit | Contoh |
|---|---|---|
| Elektrolisis | Sebagai media penghantar ion | Produksi aluminium |
| Pengawetan makanan | Menghambat pertumbuhan mikroorganisme | Cuka |
| Pembersihan | Melarutkan kotoran dan noda | Pembersih rumah tangga |
Memahami sifat kelistrikan senyawa kovalen merupakan kunci untuk pengembangan teknologi dan inovasi di berbagai bidang. Pengetahuan ini memungkinkan kita untuk merancang dan mengoptimalkan proses industri, menciptakan produk-produk baru yang lebih efisien dan ramah lingkungan, serta meningkatkan kualitas hidup manusia.
Ringkasan Akhir
Singkatnya, kemampuan senyawa kovalen untuk menjadi elektrolit bukanlah pengecualian, melainkan peristiwa kimia yang menarik yang perlu dikaji lebih lanjut. Memahami kondisi yang memungkinkan senyawa kovalen untuk terionisasi dan menghantarkan listrik memiliki implikasi luas dalam berbagai bidang. Dari pengembangan baterai hingga pemahaman proses biologis, pengetahuan ini memberikan wawasan yang berharga untuk inovasi dan pengembangan teknologi di masa depan. Penting untuk diingat bahwa tidak semua senyawa kovalen bersifat elektrolit; hanya senyawa kovalen tertentu yang memenuhi syarat khusus yang dapat menghantarkan listrik dalam larutan.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya