Mengapa larutan elektrolit dapat menghantarkan arus listrik? Pertanyaan ini mengantar kita pada dunia mikroskopis, di mana partikel-partikel bermuatan memainkan peran kunci. Bayangkan lautan molekul yang terpecah menjadi ion-ion bermuatan positif dan negatif, bergerak bebas dan siap merespon rangsangan listrik. Ini bukanlah sihir, melainkan kimia dasar yang menjelaskan mengapa baterai ponsel kita bekerja, mengapa tubuh kita berfungsi, dan mengapa berbagai teknologi modern bergantung pada kemampuan larutan elektrolit untuk menghantarkan arus listrik. Fenomena ini mendasari banyak inovasi, dari kendaraan listrik hingga sistem penyimpanan energi yang efisien. Memahami prinsip dasar ini membuka pintu menuju pemahaman yang lebih dalam tentang dunia teknologi dan alam sekitar kita.
Larutan elektrolit, dengan kemampuannya menghantarkan arus listrik, merupakan kunci dari berbagai proses penting. Kehadiran ion-ion bermuatan dalam larutan ini memungkinkan pergerakan muatan listrik, sehingga menciptakan aliran arus. Proses ionisasi, di mana senyawa terurai menjadi ion-ion, merupakan faktor penentu daya hantar listrik larutan. Semakin banyak ion yang terbentuk, semakin tinggi daya hantarnya. Pemahaman tentang konsentrasi ion, jenis elektrolit, dan faktor-faktor lainnya sangat penting untuk mendesain dan mengembangkan teknologi yang memanfaatkan sifat unik larutan elektrolit ini.
Larutan Elektrolit dan Daya Hantar Listrik
Kemampuan suatu larutan untuk menghantarkan arus listrik merupakan fenomena dasar dalam kimia. Pemahaman tentang larutan elektrolit, yang berperan kunci dalam proses ini, sangat krusial dalam berbagai aplikasi, mulai dari baterai hingga proses industri. Artikel ini akan mengupas tuntas pengertian larutan elektrolit, perbedaannya dengan larutan non-elektrolit, serta contoh-contohnya yang relevan dengan kehidupan sehari-hari.
Definisi Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena mengandung ion-ion bermuatan listrik. Keberadaan ion-ion ini memungkinkan arus listrik mengalir melalui larutan. Ion-ion tersebut terbentuk ketika senyawa elektrolit terlarut dalam pelarut, biasanya air, dan mengalami proses disosiasi atau ionisasi. Proses ini melepaskan ion-ion positif (kation) dan ion-ion negatif (anion) yang bebas bergerak dan membawa muatan listrik.
Contoh Larutan Elektrolit Kuat dan Lemah
Elektrolit diklasifikasikan menjadi dua jenis utama: elektrolit kuat dan elektrolit lemah. Perbedaannya terletak pada seberapa banyak senyawa tersebut terionisasi dalam larutan. Elektrolit kuat terionisasi sempurna, sementara elektrolit lemah hanya terionisasi sebagian.
Kemampuan larutan elektrolit menghantarkan listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Gerakan ion ini, layaknya arus lalu lintas yang dinamis, memungkinkan aliran muatan listrik. Analogi ini mengingatkan kita pada pentingnya menghargai setiap peran dalam sistem, seperti yang dijelaskan dalam artikel ini mengapa kita harus menghargai pekerjaan orang lain , setiap kontribusi, sekecil apapun, sama pentingnya untuk keberhasilan keseluruhan.
Sama seperti ion-ion dalam larutan elektrolit, kerja sama dan apresiasi antar individu menghasilkan sistem yang efektif dan efisien dalam menghantarkan – dalam hal ini – sukses bersama. Tanpa apresiasi tersebut, sistem akan terhambat, sebagaimana larutan non-elektrolit yang tak mampu menghantarkan arus listrik karena minimnya ion bebas bergerak.
- Elektrolit Kuat: Natrium klorida (NaCl), Asam klorida (HCl). NaCl dalam air terdisosiasi sempurna menjadi Na+ dan Cl–. Begitu pula HCl terionisasi sempurna menjadi H+ dan Cl–.
- Elektrolit Lemah: Asam asetat (CH3COOH), Amonia (NH3). Asam asetat hanya terionisasi sebagian menjadi CH3COO– dan H+, begitu pula amonia yang hanya sebagian kecil terionisasi menjadi NH4+ dan OH–.
Perbandingan Sifat Larutan Elektrolit Kuat dan Lemah
Tabel berikut merangkum perbedaan sifat larutan elektrolit kuat dan lemah. Daya hantar listrik yang tinggi pada elektrolit kuat mencerminkan jumlah ion yang banyak dalam larutan, sedangkan derajat ionisasi yang mendekati 100% menunjukkan hampir semua molekul terionisasi.
| Nama Elektrolit | Jenis | Daya Hantar | Derajat Ionisasi |
|---|---|---|---|
| Natrium klorida (NaCl) | Kuat | Tinggi | ≈ 100% |
| Asam klorida (HCl) | Kuat | Tinggi | ≈ 100% |
| Asam asetat (CH3COOH) | Lemah | Rendah | < 100% |
| Amonia (NH3) | Lemah | Rendah | < 100% |
Perbedaan Larutan Elektrolit dan Non-Elektrolit
Perbedaan mendasar terletak pada kemampuan menghantarkan arus listrik. Larutan elektrolit menghantarkan arus listrik karena adanya ion-ion bebas, sementara larutan non-elektrolit tidak menghantarkan arus listrik karena tidak mengandung ion-ion bebas. Gula terlarut dalam air, misalnya, merupakan larutan non-elektrolit. Molekul gula tetap utuh dan tidak terurai menjadi ion.
Kemampuan larutan elektrolit menghantarkan listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ini berbeda dengan dampak perubahan iklim; pemanasan global, misalnya, mengakibatkan perubahan drastis pada habitat, yang berujung pada kepunahan spesies. Untuk memahami lebih lanjut bagaimana hal ini terjadi, silahkan baca penjelasan detailnya di mengapa pemanasan global dapat menyebabkan kepunahan spesies jelaskan.
Kembali ke larutan elektrolit, pergerakan ion-ion ini, dipicu oleh medan listrik, menciptakan aliran muatan listrik yang kita kenal sebagai arus listrik. Intinya, pergerakan partikel bermuatan adalah kunci, baik dalam konduksi listrik maupun dalam dampak lingkungan yang kompleks seperti kepunahan spesies akibat pemanasan global.
Ilustrasi Struktur Partikel
Bayangkan larutan elektrolit seperti ruangan ramai yang dipenuhi orang-orang (ion) yang bergerak bebas dan membawa muatan. Arus listrik dapat mengalir dengan mudah karena ada jalur bagi muatan untuk berpindah. Sebaliknya, larutan non-elektrolit seperti ruangan kosong tanpa penghuni, tidak ada muatan yang dapat bergerak bebas untuk menghantarkan arus listrik. Struktur partikel yang terionisasi pada larutan elektrolit memungkinkan terjadinya perpindahan muatan, sedangkan pada larutan non-elektrolit, partikel-partikelnya netral dan tidak terionisasi sehingga tidak memungkinkan terjadinya perpindahan muatan.
Proses Ionisasi dalam Larutan Elektrolit
Kemampuan larutan elektrolit menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Proses pembentukan ion-ion ini, yang disebut ionisasi, merupakan kunci pemahaman konduktivitas listrik dalam larutan. Proses ini dapat terjadi melalui dua mekanisme utama: disosiasi senyawa ionik dan ionisasi senyawa kovalen polar. Pemahaman mendalam tentang kedua proses ini penting untuk menjelaskan perilaku elektrolit dalam berbagai aplikasi, dari baterai hingga sistem biologis.
Disosiasi Senyawa Ionik dalam Air
Senyawa ionik, seperti garam dapur (NaCl), tersusun dari kation (ion bermuatan positif) dan anion (ion bermuatan negatif) yang terikat melalui gaya elektrostatik yang kuat. Dalam air, molekul air polar (H₂O) dengan muatan parsial positif pada atom hidrogen dan muatan parsial negatif pada atom oksigen, akan mengelilingi ion-ion dalam senyawa ionik. Interaksi ini disebut solvasi, dan mampu melemahkan ikatan elektrostatik antara kation dan anion. Proses ini kemudian memisahkan ion-ion tersebut, membentuk ion-ion bebas yang bergerak dan menghantarkan arus listrik. Bayangkan molekul air seperti sekumpulan magnet kecil yang menarik dan memisahkan ion-ion positif dan negatif dalam kristal garam, sehingga ion-ion tersebut dapat bergerak bebas di dalam larutan.
Ionisasi Senyawa Kovalen Polar dalam Air
Senyawa kovalen polar, seperti asam klorida (HCl), memiliki ikatan kovalen di mana elektron terbagi tidak merata antara atom-atom penyusunnya, menghasilkan muatan parsial positif dan negatif pada atom-atom tersebut. Ketika senyawa kovalen polar terlarut dalam air, molekul air polar akan berinteraksi dengan molekul senyawa kovalen polar. Interaksi ini menyebabkan pemutusan ikatan kovalen dan pembentukan ion-ion. Molekul air, dengan kepolarannya, menarik atom hidrogen dari HCl, menghasilkan ion H⁺ (proton) dan ion Cl⁻ (klorida). Proses ini, berbeda dengan disosiasi, melibatkan pembentukan ion-ion baru dari molekul netral.
Contoh Reaksi Ionisasi Senyawa Elektrolit
- NaCl (aq) → Na⁺(aq) + Cl⁻(aq): Disosiasi garam dapur (natrium klorida) dalam air menghasilkan ion natrium dan ion klorida.
- HCl (aq) → H⁺(aq) + Cl⁻(aq): Ionisasi asam klorida dalam air menghasilkan ion hidrogen dan ion klorida.
- NaOH (aq) → Na⁺(aq) + OH⁻(aq): Disosiasi natrium hidroksida dalam air menghasilkan ion natrium dan ion hidroksida.
Peran Air sebagai Pelarut dalam Proses Ionisasi
Air, sebagai pelarut polar, memiliki peran krusial dalam proses ionisasi. Kepolaran molekul air memungkinkan interaksi kuat dengan baik senyawa ionik maupun kovalen polar, melemahkan ikatan dan memfasilitasi pembentukan ion-ion bebas yang dapat menghantarkan arus listrik. Tanpa air, atau pelarut polar lainnya, senyawa elektrolit akan tetap dalam bentuk molekul netral dan tidak dapat menghantarkan arus listrik. Sifat unik air sebagai pelarut universal ini menjadi dasar penting dalam berbagai proses kimia dan biologi.
Peran Ion dalam Menghantarkan Arus Listrik: Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik

Kemampuan larutan elektrolit menghantarkan arus listrik merupakan fenomena dasar yang mendasari berbagai teknologi, mulai dari baterai hingga proses elektroplating. Pemahaman mendalam tentang peran ion dalam proses ini krusial untuk mengoptimalkan aplikasi-aplikasi tersebut. Intinya, kemampuan hantaran listrik tersebut bergantung pada keberadaan dan mobilitas ion-ion bermuatan dalam larutan.
Larutan elektrolit, berbeda dengan air murni, mengandung partikel bermuatan yang disebut ion. Ion-ion inilah yang menjadi kunci kemampuan larutan untuk menghantarkan arus listrik. Prosesnya melibatkan pergerakan ion-ion tersebut di bawah pengaruh medan listrik eksternal. Bayangkan sebuah baterai yang terhubung ke dua elektroda yang dicelupkan ke dalam larutan elektrolit. Perbedaan potensial yang dihasilkan baterai memaksa ion-ion bergerak, menghasilkan aliran arus listrik.
Gerakan Ion dalam Medan Listrik
Ketika medan listrik diterapkan pada larutan elektrolit, ion-ion positif (kation) akan bergerak menuju elektroda negatif (katoda), sementara ion-ion negatif (anion) akan bergerak menuju elektroda positif (anoda). Pergerakan terarah inilah yang membentuk arus listrik. Kecepatan pergerakan ion dipengaruhi oleh beberapa faktor, termasuk kekuatan medan listrik, ukuran dan muatan ion, serta viskositas larutan. Analogikan seperti lalu lintas kendaraan: semakin besar medan listrik, semakin cepat kendaraan (ion) bergerak. Namun, jika jalan (larutan) terlalu padat atau kendaraan (ion) terlalu besar, kecepatan akan berkurang.
Analogi Hantaran Arus Listrik
Sebagai analogi sederhana, bayangkan sebuah selang berisi bola-bola kecil bermuatan. Bola-bola positif dan negatif akan bergerak ke arah berlawanan jika kita meniup udara dari satu sisi selang. Aliran bola-bola ini mewakili arus listrik, sedangkan tekanan udara mewakili medan listrik. Semakin kuat tiupan udara (medan listrik), semakin cepat bola-bola (ion) bergerak, dan semakin besar arus listrik yang dihasilkan.
Faktor-faktor yang Mempengaruhi Daya Hantar Listrik
Beberapa faktor secara signifikan mempengaruhi daya hantar listrik larutan elektrolit. Memahami faktor-faktor ini penting untuk mengontrol dan memprediksi kemampuan hantaran listrik suatu larutan.
Kemampuan larutan elektrolit menghantarkan listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ion-ion ini, hasil disosiasi senyawa elektrolit dalam pelarut, membawa muatan listrik sehingga memungkinkan aliran arus. Proses ini, sebagaimana kompleksitas sejarah, memiliki analogi menarik. Perkembangan pesat Islam di Indonesia, sebagaimana dijelaskan secara detail di faktor penyebab islam berkembang pesat di indonesia adalah , juga melibatkan berbagai faktor yang saling berinteraksi dan menghasilkan suatu dinamika yang kompleks.
Kembali ke larutan elektrolit, pergerakan ion-ion ini, mirip dengan penyebaran ideologi, membutuhkan kondisi yang memungkinkan, sehingga menciptakan suatu arus yang kuat dan efisien.
- Konsentrasi ion: Semakin tinggi konsentrasi ion dalam larutan, semakin besar daya hantar listriknya. Ini karena semakin banyak pembawa muatan yang tersedia untuk bergerak dan menghantarkan arus.
- Jenis ion: Ukuran dan muatan ion berpengaruh pada mobilitasnya. Ion yang lebih kecil dan bermuatan lebih tinggi akan memiliki mobilitas yang lebih besar, sehingga meningkatkan daya hantar listrik.
- Suhu: Peningkatan suhu biasanya meningkatkan daya hantar listrik karena meningkatkan energi kinetik ion, sehingga mobilitasnya meningkat.
- Pelarut: Sifat pelarut, seperti konstanta dielektrik, juga mempengaruhi daya hantar listrik. Pelarut dengan konstanta dielektrik tinggi akan mengurangi gaya tarik menarik antar ion, meningkatkan mobilitasnya.
Hubungan Konsentrasi Ion dengan Daya Hantar Listrik
Terdapat hubungan langsung antara konsentrasi ion dan daya hantar listrik. Semakin tinggi konsentrasi ion, semakin banyak pembawa muatan yang tersedia untuk bergerak, sehingga daya hantar listrik meningkat. Namun, hubungan ini tidak selalu linier, terutama pada konsentrasi tinggi, di mana interaksi antar ion dapat mengurangi mobilitasnya.
| Konsentrasi Ion | Daya Hantar Listrik |
|---|---|
| Rendah | Rendah |
| Sedang | Sedang |
| Tinggi | Tinggi (namun dapat menurun pada konsentrasi sangat tinggi karena interaksi antar ion) |
Contoh Penerapan Larutan Elektrolit sebagai Penghantar Listrik

Kemampuan larutan elektrolit untuk menghantarkan arus listrik dimanfaatkan secara luas dalam berbagai teknologi dan aplikasi sehari-hari. Mulai dari baterai yang memberi daya pada perangkat elektronik hingga proses elektroplating yang meningkatkan daya tahan logam, prinsip dasar konduktivitas elektrolit berperan krusial. Pemahaman mendalam tentang bagaimana konsentrasi elektrolit memengaruhi kinerja alat-alat ini sangat penting untuk optimasi dan pengembangan teknologi yang lebih efisien.
Penerapan Larutan Elektrolit dalam Baterai
Baterai, sumber energi portabel yang sangat umum, bergantung pada reaksi elektrokimia dalam larutan elektrolit. Reaksi redoks yang terjadi antara elektroda menghasilkan aliran elektron yang menghasilkan arus listrik. Konsentrasi elektrolit yang tepat menentukan efisiensi dan daya tahan baterai.
Prinsip kerjanya melibatkan pergerakan ion dalam larutan elektrolit antara dua elektroda (anoda dan katoda). Perbedaan potensial antara elektroda mendorong ion-ion untuk bergerak, menghasilkan arus listrik. Jenis elektrolit yang digunakan bervariasi tergantung pada jenis baterai, misalnya baterai alkali menggunakan larutan kalium hidroksida (KOH), sementara baterai asam timbal menggunakan larutan asam sulfat (H₂SO₄).
Aplikasi Larutan Elektrolit dalam Elektroplating
Elektroplating, proses melapisi suatu logam dengan logam lain menggunakan arus listrik, merupakan aplikasi penting lainnya dari konduktivitas elektrolit. Proses ini meningkatkan daya tahan korosi, estetika, dan sifat-sifat lainnya dari logam yang dilapisi.
Proses elektroplating melibatkan pencelupan objek logam ke dalam larutan elektrolit yang mengandung ion logam yang akan melapisi objek tersebut. Arus listrik dialirkan melalui larutan, menyebabkan ion logam tereduksi dan menempel pada permukaan objek. Konsentrasi elektrolit menentukan ketebalan dan kualitas lapisan logam yang dihasilkan. Contohnya, untuk melapisi perhiasan dengan emas, digunakan larutan elektrolit yang mengandung garam emas.
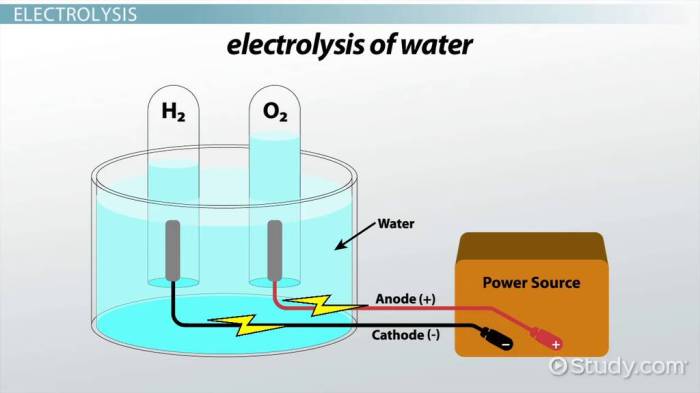
Penggunaan Larutan Elektrolit dalam Sel Elektrolisis, Mengapa larutan elektrolit dapat menghantarkan arus listrik
Sel elektrolisis memanfaatkan arus listrik untuk menguraikan senyawa kimia dalam larutan elektrolit. Proses ini memiliki aplikasi luas dalam industri kimia, seperti produksi klorin dan natrium hidroksida dari larutan garam.
Dalam sel elektrolisis, arus listrik dipaksakan melalui larutan elektrolit, menyebabkan reaksi redoks yang tidak spontan terjadi. Konsentrasi elektrolit dan tegangan yang diterapkan mempengaruhi efisiensi proses elektrolisis. Sebagai contoh, elektrolisis air menggunakan larutan elektrolit seperti asam sulfat atau natrium hidroksida untuk meningkatkan konduktivitas dan menghasilkan hidrogen dan oksigen.
Tabel Ringkasan Penerapan Larutan Elektrolit
| Penerapan | Prinsip Kerja | Jenis Elektrolit | Gambar Ilustrasi Sederhana |
|---|---|---|---|
| Baterai Alkali | Pergerakan ion dalam larutan KOH antara elektroda menghasilkan arus listrik. | Kalium Hidroksida (KOH) | Diagram sederhana baterai dengan elektroda dan larutan KOH di tengah, menunjukkan aliran ion. |
| Elektroplating Emas | Ion emas dalam larutan tereduksi dan menempel pada permukaan objek karena arus listrik. | Garam emas (misalnya, kalium aurosianida) | Gambar sederhana objek yang dicelupkan dalam larutan, dengan arus listrik yang mengalir dan ion emas yang menempel. |
| Elektrolisis Air | Arus listrik menguraikan air menjadi hidrogen dan oksigen. | Asam sulfat (H₂SO₄) atau Natrium Hidroksida (NaOH) | Diagram sederhana sel elektrolisis dengan elektroda dan larutan elektrolit, menunjukkan produksi gas hidrogen dan oksigen. |
Pengaruh Konsentrasi Elektrolit terhadap Kinerja Alat
Konsentrasi elektrolit secara langsung memengaruhi daya hantar listrik larutan. Semakin tinggi konsentrasi elektrolit, semakin banyak ion yang tersedia untuk membawa muatan listrik, sehingga konduktivitas meningkat. Hal ini berdampak pada efisiensi alat yang memanfaatkan daya hantar listrik larutan elektrolit. Misalnya, dalam baterai, konsentrasi elektrolit yang rendah dapat menyebabkan penurunan tegangan dan daya tahan baterai. Sebaliknya, konsentrasi yang terlalu tinggi dapat menyebabkan korosi pada elektroda dan mengurangi umur pakai baterai.
Pada proses elektroplating, konsentrasi elektrolit yang optimal memastikan ketebalan dan kualitas lapisan yang diinginkan. Konsentrasi yang terlalu rendah akan menghasilkan lapisan yang tipis dan tidak merata, sedangkan konsentrasi yang terlalu tinggi dapat menyebabkan lapisan yang kasar dan berpori. Efisiensi proses elektrolisis juga dipengaruhi oleh konsentrasi elektrolit. Konsentrasi yang rendah dapat memperlambat proses, sedangkan konsentrasi yang tinggi dapat meningkatkan efisiensi tetapi juga meningkatkan biaya operasional.
Kesimpulan Akhir
Singkatnya, kemampuan larutan elektrolit untuk menghantarkan arus listrik merupakan fenomena fundamental yang didorong oleh keberadaan ion-ion bermuatan. Kebebasan gerak ion-ion ini dalam merespon medan listrik memungkinkan terjadinya aliran arus. Memahami proses ionisasi dan faktor-faktor yang mempengaruhinya sangat krusial, tidak hanya untuk pemahaman ilmiah, tetapi juga untuk pengembangan teknologi masa depan yang bergantung pada sifat unik ini. Dari baterai hingga sel-sel tubuh kita, fenomena ini berperan penting dalam berbagai aspek kehidupan.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya



