NH3 asam atau basa? Pertanyaan ini mungkin tampak sederhana, namun jawabannya membuka pintu menuju dunia kimia yang menarik. Amonia (NH3), senyawa nitrogen yang sederhana, berperan penting dalam berbagai industri, dari pertanian hingga farmasi. Sifatnya sebagai basa lemah, menentukan bagaimana ia berinteraksi dengan lingkungan dan mempengaruhi proses-proses kimia yang vital. Pemahaman mendalam tentang sifat kimia NH3, reaksi-reaksnya, dan penerapannya, crucial untuk mengapresiasi perannya dalam kehidupan modern dan mengelola dampaknya terhadap lingkungan. Mari kita telusuri lebih dalam misteri kimiawi di balik senyawa sederhana ini.
Sifat basa lemah NH3 ditentukan oleh kemampuannya menerima proton (ion H+) dari asam. Reaksi dengan air menghasilkan ion amonium (NH4+) dan ion hidroksida (OH-), yang menandai sifat alkalinya. Kekuatan basa NH3 jauh lebih rendah dibandingkan basa kuat seperti NaOH atau KOH. Struktur molekulnya, dengan pasangan elektron bebas pada atom nitrogen, memungkinkan NH3 untuk membentuk ikatan hidrogen, sekaligus mempengaruhi sifat-sifat fisik dan kimianya. Pemahaman ini penting dalam memprediksi dan mengontrol reaksi-reaksi yang melibatkan amonia, terutama dalam aplikasi industri.
Sifat Kimia NH₃
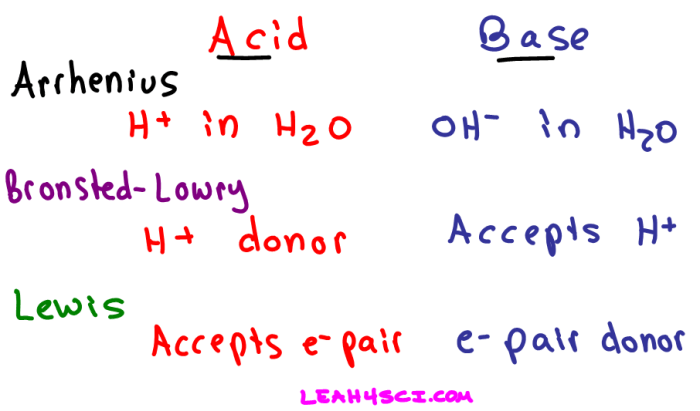
Amonia (NH₃), senyawa kimia yang umum dijumpai, memiliki peran krusial dalam berbagai proses industri dan biologi. Pemahaman mendalam tentang sifat kimianya, khususnya sebagai basa, sangat penting. Artikel ini akan mengupas tuntas karakteristik NH₃ sebagai basa lemah, meliputi reaksi dengan air, kesetimbangan yang terjadi, serta perbandingannya dengan basa kuat lainnya.
NH₃ sebagai Basa Lemah
Amonia diklasifikasikan sebagai basa lemah. Berbeda dengan basa kuat seperti NaOH yang terionisasi sempurna dalam air, NH₃ hanya terionisasi sebagian. Hal ini berarti hanya sebagian kecil molekul NH₃ yang bereaksi dengan air untuk membentuk ion. Sifat basa lemah ini menentukan perilakunya dalam berbagai reaksi kimia dan aplikasi praktisnya.
Reaksi NH₃ dengan Air dan Kesetimbangannya
Reaksi amonia dengan air merupakan reaksi kesetimbangan, yang berarti reaksi berlangsung dua arah secara simultan. Amonia menerima proton (H⁺) dari air, membentuk ion amonium (NH₄⁺) dan ion hidroksida (OH⁻). Reaksi ini dapat dituliskan sebagai berikut:
NH₃(aq) + H₂O(l) ⇌ NH₄⁺(aq) + OH⁻(aq)
Kesetimbangan ini digambarkan oleh konstanta kesetimbangan basa (Kb), yang menunjukkan kecenderungan NH₃ untuk menerima proton. Nilai Kb yang relatif kecil menunjukkan bahwa kesetimbangan lebih condong ke arah reaktan (NH₃ dan H₂O), menunjukkan sifat basa lemahnya.
Pasangan Asam-Basa Konjugat
Dalam reaksi NH₃ dengan air, terbentuk pasangan asam-basa konjugat. NH₃ bertindak sebagai basa, menerima proton dan membentuk asam konjugatnya, NH₄⁺. Sebaliknya, H₂O bertindak sebagai asam, melepaskan proton dan membentuk basa konjugatnya, OH⁻. Konsep pasangan konjugat ini penting dalam memahami reaksi asam-basa.
Perbandingan Kekuatan Basa
Berikut perbandingan kekuatan basa NH₃ dengan basa kuat lainnya:
| Nama Basa | Rumus Kimia | Kekuatan Basa |
|---|---|---|
| Amonia | NH₃ | Lemah |
| Natrium Hidroksida | NaOH | Kuat |
| Kalium Hidroksida | KOH | Kuat |
Struktur Molekul NH₃ dan Sifat Basanya
Struktur molekul NH₃ berbentuk piramida trigonal, dengan atom nitrogen di pusat dan tiga atom hidrogen di sudut-sudutnya. Pasangan elektron bebas pada atom nitrogen inilah yang memungkinkan NH₃ untuk menerima proton dari air, sehingga menunjukkan sifat basanya. Kemampuan atom nitrogen untuk menarik elektron dari atom hidrogen dalam molekul air mengakibatkan pelepasan ion OH⁻ dan pembentukan ion amonium. Struktur ini berperan kunci dalam menentukan kekuatan basa NH₃ yang relatif lemah.
Amonia (NH3), bersifat basa, bereaksi dengan air membentuk ion hidroksida. Kemampuannya mengikat proton inilah yang membuatnya berbeda dari asam. Membayangkan proses kimiawi ini mengingatkan kita pada kerumitan emosi manusia, seperti yang diungkapkan dalam mengapa seseorang menulis surat pribadi , sebuah ungkapan perasaan yang kompleks dan personal, mirip dengan ikatan kimia yang kuat.
Kembali ke NH3, sifat basanya berperan penting dalam berbagai proses industri dan lingkungan, menunjukkan betapa suatu senyawa sederhana bisa memiliki dampak yang luas.
Reaksi NH₃ dengan Asam
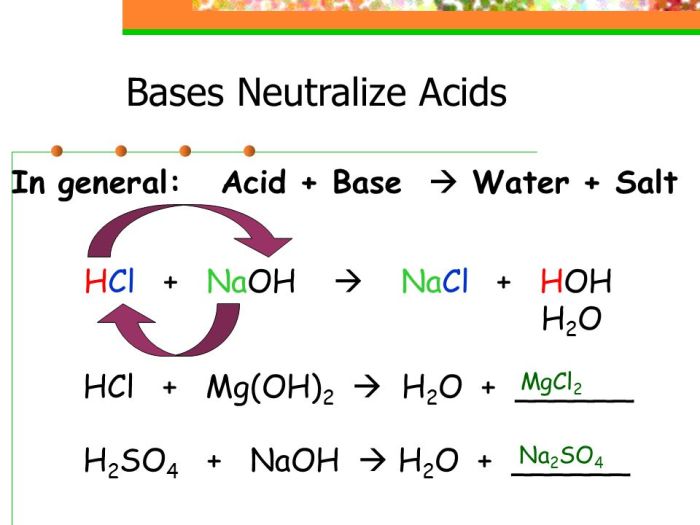
Amonia (NH₃), senyawa nitrogen yang dikenal sebagai basa lemah, bereaksi secara khas dengan asam, baik asam kuat maupun asam lemah. Reaksi ini merupakan reaksi netralisasi, menghasilkan garam dan air. Pemahaman reaksi ini krusial dalam berbagai aplikasi, mulai dari industri pupuk hingga proses kimia di laboratorium. Reaksi ini juga berperan penting dalam kesetimbangan asam-basa dan menentukan pH larutan.
Reaksi NH₃ dengan Asam Kuat
Ketika amonia bereaksi dengan asam kuat seperti asam klorida (HCl), terjadi reaksi netralisasi yang relatif sempurna. Ion hidrogen (H⁺) dari asam kuat akan bereaksi dengan molekul amonia (NH₃) membentuk ion amonium (NH₄⁺). Reaksi ini bersifat eksotermik, artinya melepaskan panas. Prosesnya cepat dan efisien, menghasilkan garam amonium klorida (NH₄Cl) dan air (H₂O). Kecepatan reaksi ini dipengaruhi oleh konsentrasi reaktan dan suhu.
Reaksi: NH₃(aq) + HCl(aq) → NH₄Cl(aq)
Reaksi NH₃ dengan Asam Asetat
Berbeda dengan asam kuat, reaksi amonia dengan asam lemah seperti asam asetat (CH₃COOH) bersifat lebih kompleks. Asam asetat hanya sebagian terionisasi dalam air, sehingga reaksi netralisasi tidak berlangsung secara sempurna. Akan tetapi, amonia tetap bereaksi dengan ion H⁺ yang tersedia dari asam asetat, membentuk ion amonium (NH₄⁺) dan ion asetat (CH₃COO⁻). Kesetimbangan reaksi ini dipengaruhi oleh konstanta disosiasi asam asetat (Ka) dan konstanta kesetimbangan reaksi (Kc).
Reaksi: NH₃(aq) + CH₃COOH(aq) ⇌ NH₄⁺(aq) + CH₃COO⁻(aq)
Produk Reaksi NH₃ dengan Asam Kuat dan Asam Lemah
Baik reaksi dengan asam kuat maupun asam lemah menghasilkan garam amonium. Namun, perbedaannya terletak pada derajat ionisasi asam dan sifat larutan garam yang dihasilkan. Reaksi dengan asam kuat menghasilkan garam amonium yang bersifat asam lemah, sementara reaksi dengan asam lemah menghasilkan garam amonium yang dapat bersifat netral, sedikit asam, atau sedikit basa, bergantung pada kekuatan relatif asam dan basa konjugatnya. Hal ini berdampak signifikan pada pH larutan akhir.
- Asam Kuat: Garam amonium yang bersifat asam lemah (contoh: NH₄Cl).
- Asam Lemah: Garam amonium yang sifatnya bergantung pada kekuatan relatif asam dan basa konjugatnya (contoh: NH₄CH₃COO).
Diagram Alir Reaksi NH₃ dengan Asam Kuat
Berikut diagram alir sederhana reaksi amonia dengan asam kuat, menggambarkan transformasi reaktan menjadi produk:
- Reaktan: NH₃(aq) + HCl(aq)
- Reaksi: Ion H⁺ dari HCl bereaksi dengan NH₃
- Intermediet: Pembentukan ikatan antara H⁺ dan NH₃ membentuk NH₄⁺
- Produk: NH₄Cl(aq) + H₂O(l)
Contoh Perhitungan pH Larutan NH₃ Setelah Bereaksi dengan Asam Kuat
Misalnya, 100 mL larutan NH₃ 0,1 M direaksikan dengan 50 mL larutan HCl 0,1 M. Setelah reaksi, kita akan memiliki larutan buffer yang mengandung NH₃ dan NH₄⁺. Perhitungan pH larutan buffer ini dapat dilakukan menggunakan persamaan Henderson-Hasselbalch, dengan memperhitungkan konsentrasi NH₃ dan NH₄⁺ yang tersisa setelah reaksi netralisasi. Perhitungan ini membutuhkan nilai pKb amonia (sekitar 4,75) dan asumsi suhu standar. Proses perhitungannya melibatkan beberapa langkah, termasuk menghitung mol NH₃ dan HCl yang bereaksi, mol NH₃ dan NH₄⁺ yang tersisa, dan kemudian memasukkannya ke dalam persamaan Henderson-Hasselbalch untuk mendapatkan nilai pH.
| Langkah | Penjelasan |
|---|---|
| 1. Hitung mol NH₃ awal | (0.1 M) x (0.1 L) = 0.01 mol |
| 2. Hitung mol HCl | (0.1 M) x (0.05 L) = 0.005 mol |
| 3. Hitung mol NH₃ sisa | 0.01 mol – 0.005 mol = 0.005 mol |
| 4. Hitung mol NH₄⁺ terbentuk | 0.005 mol |
| 5. Hitung konsentrasi NH₃ dan NH₄⁺ | [NH₃] = 0.005 mol / 0.15 L ≈ 0.033 M; [NH₄⁺] ≈ 0.033 M |
| 6. Gunakan persamaan Henderson-Hasselbalch: pH = pKa + log([NH₃]/[NH₄⁺]) | pH = 14 – pKb + log(1) ≈ 9.25 (dengan pKb NH₃ ≈ 4.75) |
Hasil perhitungan menunjukkan bahwa pH larutan setelah reaksi berada di atas 7, mengindikasikan sifat basa lemah dari larutan buffer yang terbentuk.
Amonia (NH₃), bersifat basa, reaksi alkalinya cukup signifikan. Memahami sifat kimia seperti ini penting, sebagaimana pentingnya memahami kontribusi Ki Hajar Dewantara bagi pendidikan Indonesia; baca selengkapnya di sini mengapa ki hajar dewantara dikenal sebagai bapak pendidikan untuk wawasan yang lebih luas. Begitu pula dengan NH₃, pemahaman mendalam tentang sifat basanya krusial dalam berbagai aplikasi, mulai dari industri pupuk hingga proses-proses kimia lainnya.
Sifat basa NH₃ ini, layaknya warisan Ki Hajar Dewantara, memiliki dampak yang luas dan mendalam.
Penerapan NH3 dalam Kehidupan Sehari-hari
Amonia (NH3), senyawa kimia yang mungkin terdengar asing bagi sebagian orang, ternyata memiliki peran krusial dalam kehidupan modern. Keberadaannya tak hanya sebatas di laboratorium kimia, tetapi juga tersebar luas dalam berbagai industri, menyokong kebutuhan manusia dari sektor pertanian hingga farmasi. Peran sentral amonia ini terutama terlihat dalam kontribusinya pada produksi pupuk, sebuah pilar utama dalam menjamin ketahanan pangan global. Namun, pemanfaatannya yang masif juga perlu diimbangi dengan kesadaran akan dampak lingkungan yang mungkin ditimbulkan.
Amonia (NH3), bersifat basa, reaksi kimianya cukup menarik. Kebersihan tubuh, seperti yang dijelaskan dalam artikel mengapa saat beribadah badan kita harus suci , merupakan simbol kesucian dan penghormatan dalam banyak ritual keagamaan. Hal ini menunjukkan keselarasan batiniah yang sejalan dengan prinsip-prinsip spiritual. Kembali ke NH3, sifat basanya berpengaruh pada berbagai reaksi kimia, termasuk dalam proses biologis.
Pemahaman sifat basa NH3 memungkinkan aplikasi yang luas dalam berbagai bidang, dari pertanian hingga industri.
Peran NH3 dalam Industri Pupuk
Amonia merupakan bahan baku utama dalam pembuatan berbagai jenis pupuk nitrogen. Sekitar 80% produksi amonia dunia dialokasikan untuk pembuatan pupuk, menunjukkan betapa pentingnya senyawa ini bagi sektor pertanian. Tanpa amonia, produksi pangan dalam skala besar akan menghadapi tantangan serius. Industri pupuk memanfaatkan amonia sebagai sumber nitrogen yang efisien dan ekonomis untuk menyuburkan tanah dan meningkatkan hasil panen. Proses Haber-Bosch, yang melibatkan reaksi antara nitrogen dan hidrogen di bawah tekanan dan suhu tinggi, menjadi kunci dalam produksi amonia dalam skala industri.
Pembuatan Pupuk Urea dari NH3, Nh3 asam atau basa
Urea, pupuk nitrogen yang paling banyak digunakan di dunia, diproduksi melalui reaksi amonia dengan karbon dioksida. Proses ini melibatkan beberapa tahapan reaksi kimia yang kompleks, namun intinya adalah penggabungan amonia dan karbon dioksida membentuk karbamida (urea). Reaksi ini menghasilkan pupuk urea yang kaya nitrogen, salah satu nutrisi penting bagi pertumbuhan tanaman. Efisiensi proses produksi urea terus ditingkatkan untuk meminimalkan biaya dan dampak lingkungan.
Penggunaan NH3 dalam Industri Farmasi
Selain di sektor pertanian, amonia juga memiliki aplikasi penting dalam industri farmasi. Amonia digunakan sebagai bahan baku dalam sintesis berbagai senyawa farmasi, termasuk beberapa jenis obat-obatan. Sifat kimianya yang unik memungkinkan amonia berperan dalam berbagai reaksi kimia dalam proses produksi obat. Meskipun tidak selalu menjadi komponen utama dalam obat jadi, amonia berperan sebagai reagen penting dalam proses pembuatannya.
Kegunaan NH3 dalam Berbagai Bidang
Kegunaan amonia sangat beragam dan meluas melampaui sektor pertanian dan farmasi. Berikut beberapa contohnya:
- Produksi asam nitrat, yang digunakan dalam pembuatan pupuk dan bahan peledak.
- Pendingin dalam sistem refrigerasi, memanfaatkan sifatnya yang mudah menguap dan menyerap panas.
- Bahan baku dalam produksi berbagai jenis plastik dan serat sintetis.
- Pengolahan air minum, untuk menetralkan keasaman dan meningkatkan pH air.
- Penggunaan dalam industri tekstil, sebagai bahan pembersih dan pencuci.
Penggunaan amonia secara berlebihan dapat menyebabkan pencemaran lingkungan, terutama pencemaran air dan udara. Emisi amonia dapat berkontribusi pada hujan asam dan eutrofikasi perairan, yang dapat merusak ekosistem dan mengancam biodiversitas. Oleh karena itu, penggunaan amonia perlu dilakukan secara bijak dan bertanggung jawab, dengan memperhatikan aspek keberlanjutan lingkungan. Pengembangan teknologi ramah lingkungan dalam produksi dan penggunaan amonia menjadi krusial untuk mengurangi dampak negatifnya terhadap lingkungan.
Perbandingan NH₃ dengan Senyawa Lain
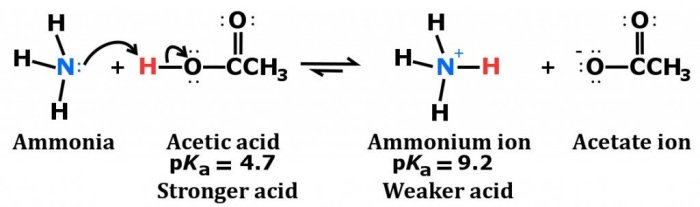
Amonia (NH₃), sebagai basa lemah, memiliki peran penting dalam berbagai industri dan proses biologis. Memahami sifat basanya dan membandingkannya dengan senyawa lain yang serupa krusial untuk aplikasi yang lebih luas. Perbandingan ini akan mengungkap perbedaan kekuatan basa, perilaku kimia, dan implikasinya dalam berbagai konteks.
Sifat Basa NH₃, Metilamina, dan Amonium Hidroksida
Amonia (NH₃), metilamina (CH₃NH₂), dan amonium hidroksida (NH₄OH) merupakan senyawa basa, namun dengan kekuatan yang berbeda. NH₃ bereaksi dengan air membentuk ion amonium (NH₄⁺) dan hidroksida (OH⁻), menunjukkan sifat basanya. Metilamina, sebagai amina primer, lebih basa daripada amonia karena gugus metil (CH₃) meningkatkan kerapatan elektron pada atom nitrogen, sehingga lebih mudah mendonorkan pasangan elektron. Sementara itu, amonium hidroksida, meskipun namanya mengandung “hidroksida,” merupakan larutan amonia dalam air, bukan senyawa tersendiri dengan ikatan kimia yang kuat antara NH₄⁺ dan OH⁻. Perbedaan kekuatan basa ini berdampak pada pH larutan dan reaktivitasnya.
Perbedaan Kekuatan Basa NH₃ dan Hidrazin
Hidrazin (N₂H₄) memiliki dua atom nitrogen yang terikat, sehingga dapat menerima dua proton. Meskipun keduanya basa lemah, hidrazin (pKb ≈ 6) lebih basa daripada amonia (pKb ≈ 4.75). Ini disebabkan oleh efek induksi dari atom nitrogen kedua yang meningkatkan kerapatan elektron pada atom nitrogen lainnya, memudahkannya menerima proton. Perbedaan kekuatan basa ini memengaruhi penggunaannya dalam berbagai aplikasi, seperti bahan bakar roket (hidrazin) dan pembuatan pupuk (amonia).
Perhitungan dan Perbandingan pKb
Konstanta basa (Kb) dan pKb digunakan untuk mengukur kekuatan basa lemah. pKb = -log Kb. Semakin kecil nilai pKb, semakin kuat basa tersebut. Untuk amonia, nilai pKb sekitar 4.75 pada suhu 25°C. Dengan membandingkan nilai pKb amonia dengan senyawa basa lemah lain, seperti piridin atau anilin, kita dapat menentukan kekuatan basa relatifnya. Misalnya, piridin memiliki pKb yang lebih tinggi daripada amonia, menunjukkan bahwa piridin adalah basa yang lebih lemah. Perhitungan ini melibatkan kesetimbangan reaksi basa lemah dengan air dan pengukuran konsentrasi ion OH⁻ yang dihasilkan.
Tabel Perbandingan Sifat Fisika dan Kimia NH₃ dan Senyawa Turunannya
| Senyawa | Titik Didih (°C) | Kelarutan dalam Air | pKb |
|---|---|---|---|
| NH₃ | -33.34 | Sangat Larut | 4.75 |
| CH₃NH₂ | -6.3 | Larut | 3.36 |
| N₂H₄ | 113.5 | Larut | ~6 |
Perbedaan Penggunaan NH₃ dengan Senyawa Basa Lain
Amonia memiliki berbagai aplikasi, terutama sebagai pupuk dalam pertanian karena nitrogen merupakan nutrisi penting bagi tanaman. Namun, sifat basanya juga dimanfaatkan dalam industri lain, seperti produksi bahan peledak, refrigeran, dan pembersih. Dibandingkan dengan senyawa basa lain, penggunaan amonia sangat dipengaruhi oleh kekuatan basanya yang relatif lemah dan ketersediaannya yang melimpah. Senyawa basa lain, seperti natrium hidroksida (NaOH) yang merupakan basa kuat, memiliki aplikasi yang berbeda, misalnya dalam pembuatan sabun dan industri kertas. Perbedaan ini disebabkan oleh tingkat reaktivitas dan bahaya yang berbeda antara basa lemah dan basa kuat.
Kesimpulan: Nh3 Asam Atau Basa
Amonia, dengan sifat basa lemahnya, merupakan senyawa serbaguna dengan peran krusial dalam berbagai sektor. Dari industri pupuk yang menyokong ketahanan pangan global hingga aplikasi di bidang farmasi yang berkontribusi pada kesehatan manusia, peran NH3 tidak dapat dipandang sebelah mata. Namun, penggunaan yang berlebihan membawa konsekuensi lingkungan yang perlu diperhatikan serius. Oleh karena itu, pengembangan teknologi yang berkelanjutan dan praktik pengelolaan yang bertanggung jawab sangat penting untuk memastikan pemanfaatan amonia yang optimal dan berkelanjutan, sehingga manfaatnya dapat dinikmati tanpa mengorbankan keseimbangan ekosistem.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya



