Apakah air termasuk senyawa? Pertanyaan sederhana ini menyimpan jawaban yang menarik dan mendalam. Air, substansi yang begitu vital bagi kehidupan, ternyata memiliki struktur kimia yang menentukan sifat-sifat uniknya. Dari tetesan embun pagi hingga samudra luas, air memainkan peran krusial dalam berbagai proses alam dan teknologi. Memahami komposisi dan sifat air sebagai senyawa kimia membuka pintu untuk mengapresiasi keajaiban alam yang sederhana namun luar biasa ini. Mari kita telusuri lebih dalam mengenai struktur molekul air dan bagaimana hal itu berpengaruh pada perannya di bumi.
Secara kimia, air didefinisikan sebagai senyawa yang terbentuk dari dua atom hidrogen dan satu atom oksigen, dihubungkan oleh ikatan kovalen. Struktur molekulnya yang polar menyebabkan air memiliki sifat-sifat unik seperti tegangan permukaan tinggi, panas spesifik tinggi, dan kemampuannya sebagai pelarut universal. Sifat-sifat ini memungkinkan air untuk mendukung kehidupan di bumi, dari proses biologis seluler hingga siklus hidrologi global. Perbedaan air dengan campuran terletak pada komposisi dan sifatnya yang tetap konsisten, berbeda dengan campuran yang komposisinya dapat bervariasi.
Definisi Air dan Senyawa
Air, substansi yang begitu vital bagi kehidupan, ternyata menyimpan rahasia kimia yang menarik. Keberadaannya yang melimpah di Bumi, menjadikan air sebagai subjek studi yang tak pernah usang. Lebih dari sekadar pelarut universal, air memiliki sifat-sifat unik yang membentuk dasar kehidupan seperti yang kita kenal. Memahami sifat kimia air berarti memahami esensi kehidupan itu sendiri. Pembahasan berikut akan mengupas definisi air dan senyawa, membandingkan karakteristik keduanya, serta mengidentifikasi unsur-unsur penyusun air.
Definisi Kimia Air dan Senyawa
Secara kimia, air adalah senyawa kimia dengan rumus molekul H₂O. Satu molekul air terdiri dari dua atom hidrogen yang terikat secara kovalen pada satu atom oksigen. Ikatan kovalen ini membentuk struktur molekul yang unik, memberikan air sifat-sifat fisik dan kimia yang khas. Senyawa, secara umum, didefinisikan sebagai zat murni yang terbentuk dari dua atau lebih unsur yang terikat secara kimia dengan perbandingan tertentu dan tetap. Ikatan kimia ini dapat berupa ikatan ionik atau kovalen, menghasilkan senyawa dengan sifat yang berbeda dari unsur penyusunnya.
Perbandingan Karakteristik Air dan Senyawa
Air, sebagai contoh senyawa, menunjukkan sifat-sifat yang khas dari senyawa secara umum. Baik air maupun senyawa lainnya memiliki komposisi tetap dan sifat-sifat yang berbeda dari unsur penyusunnya. Misalnya, hidrogen dan oksigen, sebagai gas yang mudah terbakar dan penunjang pembakaran, berubah menjadi air, sebuah cairan yang memadamkan api. Namun, air juga memiliki sifat-sifat unik yang tidak selalu ditemukan pada semua senyawa, seperti tegangan permukaan yang tinggi dan kapasitas panas jenis yang besar. Sifat-sifat ini berperan penting dalam siklus hidrologi dan pengaturan suhu di Bumi.
Tabel Perbandingan Air dan Campuran
Perbedaan mendasar antara senyawa dan campuran terletak pada komposisinya. Senyawa memiliki komposisi tetap, sementara campuran memiliki komposisi variabel. Berikut tabel perbandingannya:
| Nama Zat | Komposisi | Sifat | Contoh |
|---|---|---|---|
| Air (H₂O) | Dua atom hidrogen dan satu atom oksigen (perbandingan tetap 2:1) | Cairan tak berwarna, tak berasa, dan tak berbau pada suhu kamar; titik didih 100°C; titik beku 0°C | Air murni, air hujan |
| Air Garam | Campuran air dan garam dengan perbandingan yang bervariasi | Sifat tergantung pada konsentrasi garam; rasa asin; titik didih dan beku berbeda dari air murni | Air laut, air garam untuk memasak |
Unsur Penyusun Air
Air tersusun atas dua unsur utama: hidrogen (H) dan oksigen (O). Atom hidrogen dan oksigen terikat bersama melalui ikatan kovalen, membentuk molekul H₂O. Proporsi atom hidrogen dan oksigen dalam air selalu tetap, yaitu dua atom hidrogen untuk setiap satu atom oksigen. Perbandingan ini menentukan sifat-sifat unik air yang mendukung kehidupan di bumi.
Struktur Molekul Air

Air, senyawa kimia yang paling melimpah di Bumi dan esensial bagi kehidupan, memiliki struktur molekul yang unik dan sederhana namun sangat berpengaruh terhadap sifat-sifatnya yang luar biasa. Pemahaman mendalam tentang struktur molekul air ini membuka jendela ke berbagai fenomena alam, dari siklus hidrologi hingga kompleksitas kehidupan biologis. Lebih dari sekadar H₂O, struktur molekul air adalah kunci untuk mengungkap misteri alam semesta.
Detail Struktur Molekul Air (H₂O)
Molekul air terdiri dari satu atom oksigen (O) yang berikatan secara kovalen dengan dua atom hidrogen (H). Ikatan kovalen ini terbentuk karena pemakaian bersama pasangan elektron antara atom oksigen dan masing-masing atom hidrogen. Oksigen, sebagai unsur yang lebih elektronegatif, menarik elektron lebih kuat daripada hidrogen, menyebabkan distribusi muatan tidak merata dalam molekul. Akibatnya, molekul air bersifat polar, dengan atom oksigen bermuatan sedikit negatif (δ-) dan atom hidrogen bermuatan sedikit positif (δ+).
Pengaruh Polaritas terhadap Sifat Air
Polaritas molekul air merupakan faktor kunci yang menentukan berbagai sifat uniknya. Sifat polar ini memungkinkan terjadinya ikatan hidrogen, yaitu interaksi antarmolekul yang relatif kuat antara atom hidrogen yang bermuatan sedikit positif pada satu molekul air dengan atom oksigen yang bermuatan sedikit negatif pada molekul air lain. Ikatan hidrogen ini bertanggung jawab atas titik didih dan titik lebur air yang relatif tinggi dibandingkan dengan senyawa lain yang memiliki massa molekul sebanding, seperti hidrogen sulfida (H₂S).
Ilustrasi Struktur Molekul Air
Bayangkan sebuah atom oksigen di pusat, dikelilingi oleh dua atom hidrogen. Sudut ikatan antara kedua atom hidrogen dan atom oksigen sekitar 104,5 derajat, bukan 180 derajat seperti yang diharapkan jika molekulnya linear. Bentuk molekul air yang bengkok ini, akibat dari pasangan elektron bebas pada atom oksigen, mengakibatkan distribusi muatan yang tidak simetris dan memperkuat sifat polarnya. Ikatan kovalen digambarkan sebagai garis penghubung antara atom oksigen dan hidrogen, sementara perbedaan muatan dapat diilustrasikan dengan simbol δ+ dan δ- pada masing-masing atom.
Perbandingan dengan Senyawa Sederhana Lain
Sebagai perbandingan, metana (CH₄) memiliki struktur tetrahedral dengan ikatan kovalen nonpolar antara karbon dan hidrogen. Karena nonpolar, metana memiliki titik didih dan titik lebur yang jauh lebih rendah daripada air. Perbedaan ini menonjolkan peran penting polaritas dan ikatan hidrogen dalam menentukan sifat fisik suatu senyawa. Contoh lain adalah amonia (NH₃), yang juga polar tetapi memiliki titik didih lebih rendah dari air karena ikatan hidrogennya lebih lemah.
Pengaruh Struktur terhadap Titik Didih dan Titik Lebur
Titik didih dan titik lebur air yang relatif tinggi merupakan konsekuensi langsung dari ikatan hidrogen antarmolekulnya. Energi yang signifikan dibutuhkan untuk mengatasi ikatan hidrogen ini, sehingga air membutuhkan energi panas yang lebih besar untuk berubah fase dari cair ke gas (titik didih) atau dari padat ke cair (titik lebur). Sifat ini memiliki implikasi penting bagi kehidupan, karena air tetap cair dalam rentang suhu yang luas, memungkinkan kehidupan berkembang di Bumi.
Sifat-Sifat Air sebagai Senyawa: Apakah Air Termasuk Senyawa
Air, senyawa sederhana dengan rumus kimia H₂O, merupakan substansi vital bagi kehidupan di Bumi. Keberadaannya yang melimpah dan sifat-sifat uniknya berperan krusial dalam berbagai proses biologis, geologis, dan bahkan industri. Memahami sifat-sifat fisika dan kimia air adalah kunci untuk mengapresiasi perannya yang fundamental dalam ekosistem global dan keberlangsungan hidup manusia.
Lima Sifat Fisika Air dan Pentingnya
Sifat fisika air menentukan bagaimana air berinteraksi dengan lingkungannya. Pemahaman mendalam tentang sifat-sifat ini penting dalam berbagai aplikasi, mulai dari rekayasa sipil hingga biologi molekuler.
Air, ya, merupakan senyawa kimia, gabungan hidrogen dan oksigen (H₂O). Pertanyaan sederhana ini mungkin terkesan sepele, namun menarik untuk dikaitkan dengan hal lain, misalnya, mencari tahu siapa kang diarani guru lagu yaiku , sebuah pertanyaan yang menunjukkan bahwa pengetahuan itu beragam dan saling terhubung. Kembali ke air, struktur molekulnya yang sederhana justru menunjukkan kompleksitas sifat-sifatnya yang menentukan peran vital air bagi kehidupan.
Jadi, jawabannya tetap ya, air adalah senyawa.
- Titik didih tinggi: Air memiliki titik didih 100°C pada tekanan atmosfer standar. Sifat ini memungkinkan air tetap cair dalam rentang suhu yang luas, mendukung kehidupan organisme akuatik.
- Kapasitas panas tinggi: Air mampu menyerap banyak panas tanpa mengalami perubahan suhu yang signifikan. Hal ini berperan penting dalam mengatur suhu planet dan melindungi organisme dari fluktuasi suhu ekstrem.
- Densitas anomali: Es, bentuk padat air, kurang padat daripada air cair. Ini menyebabkan es mengapung di permukaan air, melindungi kehidupan akuatik di bawahnya dari pembekuan total.
- Tegangan permukaan tinggi: Air memiliki tegangan permukaan yang tinggi, memungkinkan air untuk naik melawan gravitasi melalui proses kapilaritas, penting untuk penyerapan air oleh tumbuhan.
- Pelarut yang baik: Air melarutkan banyak zat, memfasilitasi reaksi kimia dan transportasi nutrisi dalam organisme hidup.
Tiga Sifat Kimia Air dan Contoh Reaksi
Sifat kimia air menentukan bagaimana air bereaksi dengan zat lain, membentuk senyawa baru dan terlibat dalam reaksi penting.
Air, H₂O, ya, merupakan senyawa. Komposisi sederhana itu menyimpan kompleksitas yang menarik untuk dikaji lebih dalam. Sebelum membahas lebih jauh, perlu diingat pentingnya persiapan matang jika ingin mewawancarai ahli kimia untuk menggali lebih dalam, seperti yang dijelaskan di apa saja yang perlu dipersiapkan sebelum melakukan wawancara dengan narasumber. Dengan persiapan yang tepat, kita bisa mendapatkan informasi akurat dan mendalam, misalnya tentang ikatan kovalen dalam molekul air dan implikasinya pada sifat-sifat uniknya.
Kembali ke pertanyaan awal, ya, air adalah senyawa, bukan unsur. Pemahaman mendalam tentang senyawa ini memerlukan riset dan perencanaan yang baik, persis seperti persiapan wawancara yang efektif.
- Sifat amfoter: Air dapat bertindak sebagai asam maupun basa, tergantung pada zat yang bereaksi dengannya. Contoh: Reaksi air dengan asam kuat seperti HCl menghasilkan ion hidronium (H₃O⁺) dan ion klorida (Cl⁻). Sebaliknya, reaksi air dengan basa kuat seperti NaOH menghasilkan ion hidroksida (OH⁻) dan ion natrium (Na⁺).
- Reaksi hidrolisis: Air dapat bereaksi dengan garam untuk menghasilkan asam atau basa. Contoh: Hidrolisis garam NaCl menghasilkan larutan netral, sementara hidrolisis garam NH₄Cl menghasilkan larutan asam.
- Reaksi dehidrasi: Air dapat dihilangkan dari molekul organik selama reaksi sintesis. Contoh: Pembentukan disakarida dari dua monosakarida disertai dengan pelepasan molekul air.
Air, dengan sifat-sifat uniknya, merupakan fondasi kehidupan di Bumi. Kapasitas panasnya yang tinggi menstabilkan suhu planet, densitas anomali es melindungi kehidupan akuatik, dan kemampuannya sebagai pelarut universal memungkinkan terjadinya reaksi biokimia yang vital. Tanpa sifat-sifat luar biasa ini, kehidupan seperti yang kita kenal mungkin tidak akan ada.
Eksperimen Sederhana untuk Menunjukkan Tegangan Permukaan Air
Eksperimen sederhana dapat dilakukan untuk menunjukkan tegangan permukaan air. Sebuah peniti atau jarum kecil dapat diletakkan perlahan di permukaan air dalam gelas. Karena tegangan permukaan air, peniti atau jarum tersebut akan mengapung, meskipun densitasnya lebih tinggi daripada air.
Peran Air sebagai Pelarut Universal, Apakah air termasuk senyawa
Kemampuan air untuk melarutkan berbagai zat, membuatnya berperan sebagai pelarut universal. Sifat polar air, dengan atom oksigen yang lebih elektronegatif daripada atom hidrogen, memungkinkan pembentukan ikatan hidrogen dengan zat polar lainnya. Hal ini memfasilitasi pelarutan berbagai senyawa ionik dan polar, yang penting dalam berbagai proses biologis, industri, dan lingkungan.
Air, senyawa sederhana yang terdiri dari dua atom hidrogen dan satu atom oksigen (H₂O), merupakan fondasi kehidupan. Perjalanan evolusi manusia, yang dimulai dari nenek moyang kita yang berjalan dengan empat kaki, menarik untuk dikaji. Proses tersebut menunjukkan betapa kompleksnya kehidupan, mirip dengan rumus kimia air yang sederhana namun vital. Tahukah Anda bahwa evolusi ini membawa kita pada pertanyaan tentang manusia kera yang berjalan tegak disebut apa?
Manusia kera yang berjalan tegak disebut sebagai hominin, sebuah langkah signifikan dalam perjalanan panjang menuju manusia modern. Kembali ke topik awal, kehadiran air sebagai senyawa sangat krusial bagi keberlangsungan proses biologis yang kompleks pada manusia, dari masa lalu hingga kini.
Perbedaan Air dengan Campuran
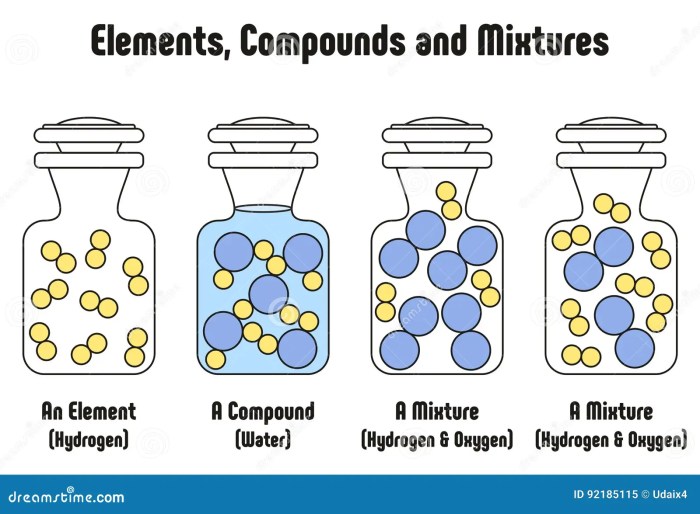
Air, zat yang begitu vital bagi kehidupan, seringkali dianggap sederhana. Namun, pemahaman mendalam tentang komposisinya—sebagai senyawa—membedakannya secara signifikan dari campuran. Perbedaan ini terletak pada tingkat ikatan antar atom penyusunnya dan konsekuensi sifat-sifat yang dihasilkan. Memahami perbedaan ini penting untuk berbagai aplikasi, mulai dari proses pemurnian air hingga pemahaman reaksi kimia dalam kehidupan sehari-hari.
Komposisi dan Sifat Air vs Campuran
Air (H₂O) adalah senyawa kimia, hasil ikatan kovalen antara dua atom hidrogen dan satu atom oksigen. Ikatan ini kuat dan menghasilkan molekul air yang stabil dengan sifat-sifat fisika dan kimia spesifik, seperti titik didih dan titik leleh yang tetap. Berbeda dengan campuran, yang merupakan gabungan dua zat atau lebih yang tidak terikat secara kimiawi. Campuran dapat memiliki komposisi yang bervariasi dan sifat-sifat yang bergantung pada proporsi komponen penyusunnya. Sebagai contoh, air garam merupakan campuran air dan garam, di mana garam terlarut dalam air tanpa membentuk ikatan kimia baru. Sifat-sifat air garam, seperti titik didih, berbeda dari air murni karena pengaruh garam yang terlarut.
Bukti Empiris Air sebagai Senyawa
Air, zat yang begitu vital bagi kehidupan, seringkali dianggap begitu sederhana. Namun, di balik kesederhanaannya tersimpan fakta ilmiah yang menarik: air merupakan senyawa, bukan unsur atau campuran. Pemahaman ini bukan sekadar pengetahuan dasar kimia, melainkan kunci untuk memahami sifat-sifat unik air yang mendukung kehidupan di bumi. Bukti empiris yang kuat mendukung klasifikasi air sebagai senyawa, mengungkap rahasia komposisinya dan bagaimana hal itu memengaruhi karakteristiknya.
Elektrolisis Air: Pembuktian Komposisi
Elektrolisis air merupakan metode eksperimental klasik yang secara meyakinkan membuktikan bahwa air tersusun atas dua unsur, yaitu hidrogen dan oksigen. Proses ini melibatkan penggunaan arus listrik untuk menguraikan molekul air (H₂O) menjadi unsur-unsur penyusunnya. Dengan mengamati hasil elektrolisis, kita dapat secara langsung membuktikan bahwa air bukanlah unsur tunggal, melainkan senyawa yang terdiri dari unsur-unsur lain yang terikat secara kimiawi.
Proses Elektrolisis Air dan Hasilnya
Dalam proses elektrolisis, air ditempatkan dalam wadah yang dilengkapi dengan dua elektroda, yaitu anoda (kutub positif) dan katoda (kutub negatif). Ketika arus listrik dialirkan, molekul air terurai. Di katoda, ion hidrogen (H⁺) menerima elektron dan membentuk gas hidrogen (H₂), yang kemudian dilepaskan sebagai gelembung gas. Sementara itu, di anoda, ion hidroksida (OH⁻) melepaskan elektron dan terurai menjadi gas oksigen (O₂) dan air. Hasilnya, kita mengamati terbentuknya gas hidrogen di katoda dan gas oksigen di anoda, dengan perbandingan volume yang konsisten.
Perbandingan Massa Hidrogen dan Oksigen
Pengukuran yang teliti menunjukkan bahwa perbandingan volume gas hidrogen dan oksigen yang dihasilkan dari elektrolisis air adalah 2:1. Lebih jauh lagi, perbandingan massa hidrogen dan oksigen adalah sekitar 1:8. Perbandingan massa ini konsisten dengan rumus kimia air (H₂O), yang menunjukkan bahwa setiap molekul air terdiri dari dua atom hidrogen dan satu atom oksigen. Konsistensi ini menjadi bukti kuat bahwa air adalah senyawa dengan komposisi yang tetap.
Implikasi Komposisi Air terhadap Sifat-Sifatnya
Komposisi air sebagai senyawa H₂O memiliki implikasi yang signifikan terhadap sifat-sifat fisik dan kimianya. Ikatan kovalen antara atom hidrogen dan oksigen menciptakan molekul air yang polar, artinya molekul air memiliki muatan positif parsial pada atom hidrogen dan muatan negatif parsial pada atom oksigen. Kepolaran ini menyebabkan terjadinya ikatan hidrogen antar molekul air, yang bertanggung jawab atas sifat-sifat unik air seperti titik didih yang relatif tinggi, tegangan permukaan yang tinggi, dan kemampuannya sebagai pelarut yang baik. Tanpa komposisi spesifik ini, air tidak akan memiliki sifat-sifat yang mendukung kehidupan seperti yang kita kenal.
Ringkasan Akhir

Kesimpulannya, air tak hanya sekadar zat cair yang kita minum setiap hari. Ia adalah senyawa dengan struktur molekul yang unik dan sifat-sifat yang luar biasa, yang mendukung kehidupan di planet kita. Pemahaman mengenai air sebagai senyawa membuka wawasan kita mengenai kompleksitas dan kecantikan dunia alam. Dari elektrolisis yang membuktikan komposisinya hingga perannya sebagai pelarut universal, air terus menawarkan misteri yang menarik untuk diungkap. Perjalanan menjelajahi dunia kimia air ini mengajarkan kita betapa hal-hal sederhana dapat memiliki dampak yang sangat besar.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya