Apakah besi berkarat termasuk perubahan kimia? Pertanyaan ini mungkin tampak sederhana, namun menyimpan kompleksitas reaksi kimia yang menarik. Proses perkaratan, yang akrab kita lihat sebagai perubahan warna dan tekstur besi menjadi cokelat kemerahan, sebenarnya merupakan transformasi mendalam pada tingkat atom. Lebih dari sekadar perubahan warna, perkaratan menandai kelahiran senyawa baru, membuktikan diri sebagai perubahan kimia yang nyata dan berpengaruh terhadap berbagai aspek kehidupan, dari konstruksi bangunan hingga kerusakan mesin. Memahami proses ini membuka jalan untuk strategi pencegahan yang efektif dan inovasi material di masa depan.
Perkaratan besi, atau korosi, adalah reaksi redoks yang melibatkan oksidasi besi oleh oksigen di udara dengan bantuan air sebagai elektrolit. Atom-atom besi melepaskan elektron, berubah menjadi ion besi (Fe2+ dan Fe3+), yang kemudian bereaksi dengan oksigen dan air membentuk senyawa hidroksida besi hidrat yang kita kenal sebagai karat. Proses ini mengubah sifat fisik besi secara signifikan, dari warna, kekerasan, hingga daya hantar listrik. Bukti eksperimental yang kuat mendukung klasifikasi perkaratan sebagai perubahan kimia, bukan perubahan fisika. Pemahaman mendalam tentang faktor-faktor yang mempengaruhi perkaratan, seperti kelembaban, konsentrasi oksigen, dan keberadaan elektrolit, sangat penting untuk mengembangkan metode pencegahan yang efektif.
Karat Besi: Perubahan Kimia yang Tak Terlihat: Apakah Besi Berkarat Termasuk Perubahan Kimia
Pernahkah Anda memperhatikan besi yang lama terpapar udara dan air? Perubahan warna menjadi cokelat kemerahan, tekstur yang rapuh, dan hilangnya kekuatan mekanis merupakan indikasi dari proses perkaratan, sebuah fenomena kimia yang merugikan dan menarik untuk dipelajari. Proses ini, lebih dari sekadar perubahan warna, merupakan transformasi kimiawi yang kompleks dengan implikasi ekonomi dan lingkungan yang signifikan. Mari kita telusuri proses perkaratan besi secara mendalam.
Proses Pembentukan Karat Besi, Apakah besi berkarat termasuk perubahan kimia
Karat besi, secara kimiawi dikenal sebagai besi(III) oksida terhidrat (Fe2O3·nH2O), terbentuk melalui proses elektrokimia yang melibatkan reaksi oksidasi-reduksi. Proses ini dimulai ketika besi terpapar oksigen (O2) dan air (H2O). Air bertindak sebagai elektrolit, memungkinkan pergerakan ion-ion. Pada permukaan besi, terjadi reaksi anodik di mana atom besi melepaskan elektron dan teroksidasi menjadi ion besi(II) (Fe2+). Elektron yang dilepaskan kemudian mengalir melalui besi menuju daerah katodik, di mana oksigen direduksi menjadi ion hidroksida (OH–). Ion besi(II) dan ion hidroksida kemudian bereaksi membentuk besi(II) hidroksida (Fe(OH)2), yang selanjutnya teroksidasi oleh oksigen menjadi besi(III) hidroksida (Fe(OH)3). Akhirnya, besi(III) hidroksida mengalami dehidrasi menjadi karat besi (Fe2O3·nH2O).
Ya, besi berkarat merupakan perubahan kimia; proses oksidasi mengubah struktur besi, membentuk senyawa baru, berbeda dari besi murni. Memahami proses ini secara visual, misalnya dalam buku teks kimia, membutuhkan strategi penyampaian informasi yang tepat, seperti yang dibahas dalam pola pengembangan ilustrasi yang efektif. Ilustrasi yang baik mampu menjelaskan perubahan warna dan tekstur pada besi yang berkarat, memperkuat pemahaman kita bahwa karat bukanlah sekadar perubahan fisik, melainkan reaksi kimia yang menghasilkan zat baru.
Singkatnya, perubahan kimia pada besi terlihat jelas lewat karat yang terbentuk.
Perubahan Kimia pada Atom Besi
Selama proses perkaratan, atom besi mengalami oksidasi, kehilangan elektron dan berubah dari keadaan logam netral menjadi ion Fe2+ dan kemudian Fe3+. Perubahan ini mengakibatkan perubahan signifikan dalam sifat kimia dan fisik besi. Elektron yang hilang berperan penting dalam reaksi reduksi oksigen, membentuk sebuah siklus elektrokimia yang terus berlangsung selama kondisi memungkinkan.
Reaksi Kimia Pembentukan Karat Besi
Reaksi pembentukan karat besi dapat disederhanakan menjadi beberapa tahapan reaksi. Secara keseluruhan, reaksi dapat digambarkan sebagai berikut:
4Fe(s) + 3O2(g) + 6H2O(l) → 4Fe(OH)3(s) → 2Fe2O3·3H2O(s)
Namun, perlu diingat bahwa reaksi sebenarnya jauh lebih kompleks dan melibatkan berbagai faktor seperti pH, suhu, dan keberadaan ion-ion lain dalam lingkungan.
Ya, besi berkarat merupakan perubahan kimia, bukan sekadar perubahan fisika. Proses perkaratan melibatkan reaksi kimia antara besi dengan oksigen di udara membentuk besi oksida. Memahami proses ini, sebagaimana kita memahami contoh penerapan teori behavioristik dalam pembelajaran, membutuhkan pemahaman mendalam terhadap mekanisme yang terjadi. Analogi perubahan perilaku manusia akibat stimulus, mirip dengan perubahan kimiawi pada besi yang terpapar lingkungan.
Jadi, perkaratan besi jelas-jelas termasuk perubahan kimia yang permanen dan menghasilkan zat baru.
Perbandingan Sifat Besi Sebelum dan Sesudah Berkarat
| Sifat | Besi | Besi Berkarat |
|---|---|---|
| Warna | Abu-abu keperakan | Cokelat kemerahan |
| Kekerasan | Relatif keras | Rapuh dan mudah hancur |
| Daya Hantar Listrik | Baik | Buruk |
Perubahan Struktur Kristal Besi Selama Oksidasi
Struktur kristal besi yang awalnya teratur dan kompak akan mengalami perubahan signifikan selama proses oksidasi. Pembentukan karat menyebabkan kerusakan pada struktur kristal, membentuk lapisan yang porous dan tidak seragam. Lapisan karat ini tidak melekat kuat pada permukaan besi, sehingga proses perkaratan dapat terus berlangsung. Kerusakan struktur kristal ini menyebabkan penurunan kekuatan dan daya tahan besi.
Ya, besi berkarat merupakan perubahan kimia, proses oksidasi yang mengubah struktur besi. Perubahan ini berbeda dengan perubahan fisika, misalnya pemotongan besi. Proses serupa juga terjadi pada pembusukan limbah organik, seperti yang dijelaskan secara detail di limbah lunak organik pada umumnya berasal dari limbah , yang melibatkan reaksi kimia kompleks. Singkatnya, karat pada besi adalah bukti nyata perubahan kimiawi yang mengubah sifat materialnya, berbeda dengan proses fisika yang hanya mengubah bentuk atau ukurannya saja.
Jadi, perkaratan besi jelas merupakan perubahan kimia.
Bukti Perubahan Kimia pada Karat Besi
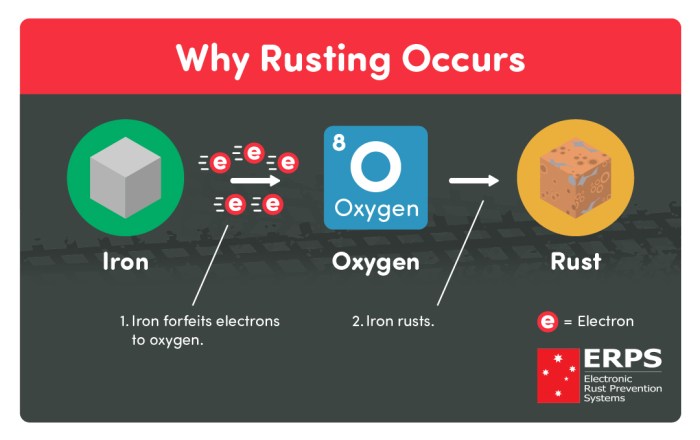
Perkaratan besi, fenomena sehari-hari yang kita amati pada benda-benda logam, lebih dari sekadar perubahan warna permukaan. Proses ini merupakan contoh klasik perubahan kimia, transformasi materi yang menghasilkan zat baru dengan sifat berbeda dari zat asalnya. Memahami perubahan kimia pada perkaratan besi penting karena implikasinya yang luas, mulai dari kerusakan infrastruktur hingga pengembangan material tahan karat. Artikel ini akan mengupas bukti-bukti ilmiah yang menguatkan klasifikasi perkaratan besi sebagai perubahan kimia.
Perubahan Sifat Fisika yang Menyertai Perkaratan Besi
Perubahan fisika, seperti perubahan bentuk atau ukuran, seringkali menyertai perubahan kimia. Pada perkaratan besi, kita melihat perubahan warna yang signifikan, dari warna abu-abu logam menjadi warna cokelat kemerahan karat. Tekstur permukaan besi juga berubah, menjadi kasar dan rapuh. Selain itu, massa besi juga akan meningkat karena penambahan atom oksigen dan air dalam proses pembentukan karat. Perubahan-perubahan ini, meskipun tampak sederhana, menunjukkan adanya transformasi mendasar pada struktur dan komposisi material.
Bukti Eksperimental Perubahan Kimia Perkaratan Besi
Beberapa eksperimen sederhana dapat menunjukkan bahwa perkaratan besi merupakan perubahan kimia. Berikut tiga bukti eksperimental yang mendukung pernyataan tersebut:
- Perubahan warna dan pembentukan senyawa baru: Besi yang berkarat menunjukkan perubahan warna yang permanen menjadi cokelat kemerahan, menandakan terbentuknya senyawa baru, yaitu hidrat besi(III) oksida (Fe2O3·nH2O). Perubahan warna ini bukan sekadar efek permukaan, melainkan indikasi perubahan komposisi kimia.
- Reaksi kimia yang irreversibel: Karat besi tidak dapat diubah kembali menjadi besi murni dengan mudah. Proses perkaratan merupakan reaksi kimia yang irreversibel, berbeda dengan perubahan fisika yang seringkali reversibel. Memanaskan karat besi tidak akan mengembalikannya ke bentuk besi asalnya.
- Evolusi gas dan perubahan massa: Proses perkaratan melibatkan reaksi dengan oksigen dan air, yang dapat menghasilkan gas hidrogen. Perubahan massa besi yang meningkat setelah berkarat juga menunjukkan adanya penambahan atom-atom dari lingkungan sekitar, sebuah karakteristik perubahan kimia.
Perbedaan Perubahan Fisika dan Kimia
Perbedaan mendasar antara perubahan fisika dan kimia dapat dipahami dengan membandingkan proses yang terjadi pada besi.
- Perubahan Fisika: Melibatkan perubahan bentuk, ukuran, atau keadaan zat tanpa mengubah komposisi kimianya. Contoh: Pemanasan kawat besi menyebabkan perubahan ukuran (memuai), tetapi komposisi kimianya tetap Fe. Penarikan kawat besi mengubah bentuknya, namun komposisi kimianya tetap sama.
- Perubahan Kimia: Melibatkan perubahan komposisi kimia zat, menghasilkan zat baru dengan sifat yang berbeda. Contoh: Perkaratan besi menghasilkan senyawa baru, hidrat besi(III) oksida (Fe2O3·nH2O), dengan sifat dan komposisi kimia yang berbeda dari besi murni.
Reaksi Perkaratan Besi vs. Proses Fisika
Perlu ditekankan bahwa perkaratan besi merupakan proses kimia yang kompleks, berbeda secara fundamental dengan proses fisika seperti pemanasan atau penarikan kawat besi. Pemanasan hanya mengubah energi kinetik atom-atom besi, sementara penarikan mengubah bentuk fisiknya tanpa mengubah komposisi kimia. Perkaratan, di sisi lain, melibatkan reaksi kimia antara besi dengan oksigen dan air, menghasilkan senyawa baru dengan sifat kimia yang berbeda.
Proses perkaratan besi merupakan perubahan kimia yang ditandai dengan perubahan warna permanen, pembentukan senyawa baru (hidrat besi(III) oksida), reaksi yang ireversibel, dan perubahan massa. Bukti-bukti ini secara meyakinkan menunjukkan bahwa perkaratan bukan sekadar perubahan fisik permukaan, melainkan transformasi kimia yang mendalam.
Faktor-faktor yang Mempengaruhi Perkaratan Besi

Perkaratan besi, atau korosi, merupakan proses elektrokimia yang merugikan, mengubah logam yang kuat menjadi oksida besi yang rapuh dan tidak berguna. Memahami faktor-faktor yang mempercepat proses ini krusial untuk mencegah kerusakan material dan kerugian ekonomi yang signifikan. Dari jembatan hingga bangunan, hingga peralatan rumah tangga, pemahaman mendalam tentang perkaratan menjadi kunci dalam memastikan keawetan infrastruktur dan aset kita.
Proses perkaratan besi dipengaruhi oleh beberapa faktor lingkungan yang saling berinteraksi. Kecepatan perkaratan dapat bervariasi drastis tergantung pada kondisi tersebut. Faktor-faktor ini berperan signifikan dalam menentukan laju dan tingkat keparahan korosi.
Faktor Lingkungan yang Mempercepat Perkaratan
Tiga faktor lingkungan utama yang mempercepat perkaratan adalah kelembaban udara, keberadaan oksigen, dan konsentrasi elektrolit dalam air. Ketiga elemen ini bekerja secara sinergis, menciptakan kondisi ideal bagi terjadinya reaksi kimia yang menghasilkan karat.
- Kelembaban Udara: Tingkat kelembaban yang tinggi menyediakan media ideal bagi reaksi elektrokimia perkaratan. Air yang menempel pada permukaan besi bertindak sebagai elektrolit, memfasilitasi pergerakan ion dan mempercepat proses oksidasi. Udara lembab memungkinkan terbentuknya lapisan tipis air pada permukaan besi, bahkan di lingkungan yang tampak kering. Semakin tinggi kelembaban, semakin cepat proses perkaratan.
- Keberadaan Oksigen: Oksigen merupakan reaktan penting dalam reaksi perkaratan. Besi bereaksi dengan oksigen membentuk oksida besi (karat). Proses ini memerlukan adanya air sebagai media reaksi. Kecepatan perkaratan berbanding lurus dengan ketersediaan oksigen di lingkungan sekitar besi.
- Konsentrasi Elektrolit dalam Air: Air murni kurang konduktif, sehingga perkaratan berlangsung lambat. Namun, kehadiran elektrolit dalam air, seperti garam atau asam, meningkatkan konduktivitas listrik, mempercepat perpindahan ion, dan secara signifikan mempercepat proses perkaratan. Air laut, misalnya, dengan kandungan garam yang tinggi, menyebabkan perkaratan jauh lebih cepat dibandingkan air tawar.
Pengaruh Kelembaban Udara terhadap Laju Perkaratan
Kelembaban udara berperan sebagai katalis dalam proses perkaratan. Air yang terkondensasi pada permukaan besi membentuk lapisan tipis yang bertindak sebagai jembatan penghantar listrik. Lapisan ini memungkinkan ion besi (Fe2+) dan ion hidroksida (OH–) untuk bermigrasi dan bereaksi, membentuk senyawa hidroksida besi. Selanjutnya, hidroksida besi bereaksi dengan oksigen membentuk karat (Fe2O3·xH2O), yang merupakan senyawa hidrat oksida besi. Semakin tinggi kelembaban, semakin tebal lapisan air, dan semakin cepat reaksi berlangsung.
Peran Oksigen dan Air dalam Pembentukan Karat Besi
Oksigen dan air merupakan elemen esensial dalam pembentukan karat. Prosesnya dimulai dengan oksidasi besi (Fe) menjadi ion besi (Fe2+) dengan melepaskan elektron. Elektron ini kemudian berpindah ke molekul oksigen (O2) yang terlarut dalam air, membentuk ion hidroksida (OH–). Reaksi antara ion besi dan ion hidroksida menghasilkan hidroksida besi, yang selanjutnya bereaksi dengan oksigen membentuk karat. Proses ini merupakan reaksi redoks (reduksi-oksidasi) yang kompleks, dan ketersediaan oksigen dan air secara langsung mempengaruhi laju reaksi.
Ilustrasi Pembentukan Karat
Bayangkan sebuah paku besi terendam sebagian dalam air yang mengandung oksigen terlarut. Bagian paku yang terendam air akan mengalami reaksi oksidasi, melepaskan elektron. Elektron tersebut akan mengalir melalui paku menuju bagian paku yang berada di atas permukaan air dan bersentuhan dengan oksigen. Di bagian atas, oksigen akan menerima elektron dan bereaksi dengan air membentuk ion hidroksida. Ion besi (Fe2+) yang terbentuk di bagian bawah paku bermigrasi melalui air menuju bagian atas dan bereaksi dengan ion hidroksida, membentuk hidroksida besi yang kemudian teroksidasi menjadi karat. Proses ini terus berlanjut, menyebabkan paku berkarat secara bertahap.
Pengaruh Perbedaan Konsentrasi Elektrolit terhadap Kecepatan Perkaratan
Konsentrasi elektrolit dalam air secara signifikan mempengaruhi kecepatan perkaratan. Elektrolit meningkatkan konduktivitas listrik air, memfasilitasi pergerakan ion-ion yang terlibat dalam reaksi perkaratan. Semakin tinggi konsentrasi elektrolit, semakin cepat ion-ion tersebut berpindah, dan semakin cepat pula proses perkaratan berlangsung. Air laut, dengan kandungan garam yang tinggi, menjadi contoh nyata bagaimana konsentrasi elektrolit yang tinggi dapat mempercepat korosi secara dramatis dibandingkan air tawar yang memiliki konsentrasi elektrolit rendah.
Pencegahan Perkaratan Besi
Perkaratan, musuh utama besi dan baja, merupakan proses elektrokimia yang merugikan. Kerugiannya tak hanya estetika, namun juga struktural, mengancam kekuatan dan umur pakai berbagai konstruksi. Memahami mekanisme perkaratan crucial untuk menerapkan langkah pencegahan yang efektif. Investasi dalam pencegahan karat jauh lebih ekonomis dibandingkan perbaikan atau penggantian material yang telah rusak. Berikut ini beberapa metode umum yang terbukti ampuh.
Metode Pencegahan Perkaratan Besi
Ada beragam cara untuk mencegah besi berkarat, masing-masing dengan prinsip kerja dan efektivitas yang berbeda. Pemilihan metode bergantung pada faktor-faktor seperti lingkungan pemaparan, jenis besi, dan anggaran biaya. Tiga metode umum yang sering diterapkan adalah pelapisan logam (galvanisasi), pengecatan, dan penggunaan inhibitor karat.
- Pelapisan Logam (Galvanisasi)
- Pengecatan
- Penggunaan Inhibitor Karat
Pelapisan Logam (Galvanisasi): Perlindungan Melalui Anoda Korban
Galvanisasi, proses pelapisan besi dengan logam lain yang lebih reaktif seperti seng (Zn), merupakan metode pencegahan karat yang sangat efektif. Prinsip kerjanya didasarkan pada konsep sel elektrokimia. Seng, sebagai logam yang lebih reaktif, akan lebih mudah teroksidasi dibandingkan besi. Akibatnya, seng akan bertindak sebagai anoda korban, melindungi besi dari korosi. Lapisan seng ini secara fisik menghalangi kontak antara besi dengan oksigen dan air, dua komponen utama dalam proses perkaratan. Jika lapisan seng tergores, seng tetap akan mengorbankan dirinya untuk melindungi besi di bawahnya. Proses ini memastikan perlindungan yang berkelanjutan, bahkan jika lapisan pelindung mengalami kerusakan sebagian.
Pengecatan: Penghalang Fisik untuk Oksigen dan Air
Pengecatan merupakan metode pencegahan karat yang sederhana dan relatif murah. Cat membentuk lapisan pelindung yang secara fisik menghalangi kontak antara besi dan lingkungan, mencegah akses oksigen dan air yang diperlukan untuk proses oksidasi. Efektivitas cat bergantung pada kualitas cat itu sendiri, ketebalan lapisan, dan persiapan permukaan besi sebelum pengecatan. Permukaan besi yang bersih dan bebas karat akan meningkatkan daya rekat cat dan meningkatkan efektivitas perlindungan. Berbagai jenis cat, mulai dari cat minyak hingga cat anti karat khusus, tersedia di pasaran, masing-masing menawarkan tingkat perlindungan yang berbeda.
Penggunaan Inhibitor Karat: Mengendalikan Reaksi Kimia
Inhibitor karat adalah bahan kimia yang ditambahkan ke lingkungan sekitar besi untuk memperlambat atau menghentikan proses perkaratan. Bahan-bahan ini bekerja dengan berbagai mekanisme, misalnya dengan membentuk lapisan pelindung pada permukaan besi, atau dengan menghambat reaksi elektrokimia yang menyebabkan perkaratan. Contoh inhibitor karat adalah kromat, nitrit, dan molibdat. Kromat, misalnya, membentuk lapisan pasif pada permukaan besi yang mencegah kontak dengan lingkungan. Namun, perlu diingat bahwa beberapa inhibitor karat bersifat toksik dan penggunaannya perlu memperhatikan aspek keselamatan dan lingkungan.
Perbandingan Efektivitas Tiga Metode Pencegahan Karat
Ketiga metode di atas memiliki tingkat efektivitas yang berbeda. Galvanisasi umumnya memberikan perlindungan yang paling tahan lama dan efektif, terutama dalam lingkungan yang korosif. Pengecatan menawarkan perlindungan yang baik, tetapi membutuhkan perawatan berkala karena lapisan cat dapat terkelupas atau rusak. Inhibitor karat efektif dalam mengendalikan laju perkaratan, tetapi tidak memberikan perlindungan fisik seperti galvanisasi atau pengecatan. Pemilihan metode yang tepat bergantung pada faktor-faktor seperti biaya, lingkungan, dan kebutuhan perlindungan yang diinginkan. Sebagai contoh, untuk struktur yang terpapar lingkungan laut yang sangat korosif, galvanisasi mungkin menjadi pilihan terbaik. Sementara itu, untuk pagar rumah di lingkungan yang relatif kering, pengecatan mungkin sudah cukup memadai.
Penutupan Akhir

Kesimpulannya, perkaratan besi bukanlah sekadar perubahan warna permukaan, melainkan perubahan kimia yang mendalam. Proses oksidasi ini menghasilkan senyawa baru dengan sifat yang berbeda dari besi awal, sekaligus membuktikan perubahan komposisi material. Memahami reaksi kimia yang terlibat, serta faktor-faktor yang mempengaruhinya, memungkinkan kita untuk mengembangkan strategi pencegahan yang efektif dan berkelanjutan. Dari pelapisan logam hingga penggunaan inhibitor karat, berbagai metode telah dikembangkan untuk melindungi besi dari korosi, menjaga integritas struktur dan fungsi berbagai peralatan di kehidupan kita sehari-hari. Penelitian terus berlanjut untuk menemukan material dan teknik yang lebih inovatif dalam melawan ancaman perkaratan.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya