Asam amino yang tidak bersifat optis aktif adalah glisin, sebuah fakta fundamental dalam biokimia. Keunikan glisin terletak pada strukturnya yang sederhana, berbeda dengan kebanyakan asam amino lainnya yang memiliki kemampuan memutar cahaya terpolarisasi. Ini berimplikasi besar pada peran glisin dalam tubuh, menunjukkan bagaimana struktur kimia memengaruhi fungsi biologis. Pemahaman mendalam tentang sifat optis aktif dan akiral asam amino crucial untuk memahami kompleksitas protein dan reaksi biokimia di dalam sel.
Glisin, dengan rumus kimia sederhana (NH2CH2COOH), tidak memiliki atom karbon kiral—atom karbon yang terikat pada empat gugus fungsi yang berbeda. Ketiadaan pusat kiral inilah yang menyebabkan glisin tidak bersifat optis aktif, berbeda dengan isomer-isomernya yang memiliki kemampuan memutar bidang cahaya terpolarisasi. Perbedaan ini memiliki implikasi yang signifikan dalam berbagai proses biologis, mulai dari pembentukan protein hingga regulasi enzim.
Asam Amino dan Isomeri: Memahami Molekul-Molekul Pembangun Kehidupan
Asam amino, blok bangunan protein, memiliki peran krusial dalam berbagai proses biologis. Pemahaman mendalam tentang struktur dan sifatnya, khususnya terkait isomeri, sangat penting untuk mengungkap kompleksitas kehidupan. Artikel ini akan mengupas pengertian asam amino, konsep kiralitas dan enantiomer, serta memberikan contoh konkret asam amino yang bersifat kiral dan akiral.
Definisi Asam Amino, Asam amino yang tidak bersifat optis aktif adalah
Secara sederhana, asam amino adalah senyawa organik yang mengandung gugus amina (-NH2) dan gugus karboksil (-COOH) yang terikat pada atom karbon alfa (α) yang sama. Atom karbon alfa ini juga terikat pada atom hidrogen dan gugus samping (R) yang membedakan satu asam amino dengan asam amino lainnya. Variasi gugus R inilah yang menentukan sifat dan fungsi masing-masing asam amino, membentuk keragaman protein yang luar biasa di alam.
Kiralitas dan Enantiomer pada Molekul Organik
Konsep kiralitas berkaitan dengan sifat molekul yang tidak dapat ditumpangkan pada bayangan cerminnya. Bayangkan sebuah tangan; tangan kanan dan kiri adalah bayangan cermin satu sama lain, tetapi tidak dapat ditumpangkan sempurna. Molekul kiral, seperti banyak asam amino, menunjukkan sifat ini. Enantiomer adalah sepasang isomer kiral yang merupakan bayangan cermin satu sama lain. Mereka memiliki sifat fisik dan kimia yang identik, kecuali dalam interaksi dengan molekul kiral lainnya, seperti enzim dalam tubuh.
Contoh Asam Amino Kiral dan Penjelasannya
Sebagian besar asam amino yang ditemukan di alam bersifat kiral, kecuali glisin. Sebagai contoh, alanin memiliki atom karbon alfa yang terikat pada empat gugus berbeda: gugus amina, gugus karboksil, atom hidrogen, dan gugus metil (CH3). Keempat gugus yang berbeda inilah yang menyebabkan alanin bersifat kiral, sehingga memiliki dua enantiomer: L-alanin dan D-alanin. Perbedaannya terletak pada konfigurasi spasial gugus-gugus tersebut di sekitar atom karbon alfa.
Gugus Fungsi Penyebab Sifat Kiral pada Asam Amino
Atom karbon alfa (α) merupakan pusat kiralitas pada sebagian besar asam amino. Keempat gugus yang terikat padanya (gugus amino, gugus karboksil, atom hidrogen, dan gugus R) harus berbeda agar molekul tersebut bersifat kiral. Jika salah satu gugus sama dengan gugus lainnya, seperti pada glisin (di mana gugus R adalah atom hidrogen), maka molekul tersebut menjadi akiral.
Perbandingan Asam Amino Kiral dan Akiral
| Nama Asam Amino | Rumus Kimia | Sifat Kiralitas | Contoh |
|---|---|---|---|
| Alanin | CH3CH(NH2)COOH | Kiral | L-Alanin dan D-Alanin |
| Glisin | H2NCH2COOH | Akiral | – |
| Serin | HOCH2CH(NH2)COOH | Kiral | L-Serin dan D-Serin |
| Sistein | HSCH2CH(NH2)COOH | Kiral | L-Sistein dan D-Sistein |
Asam Amino Akiral
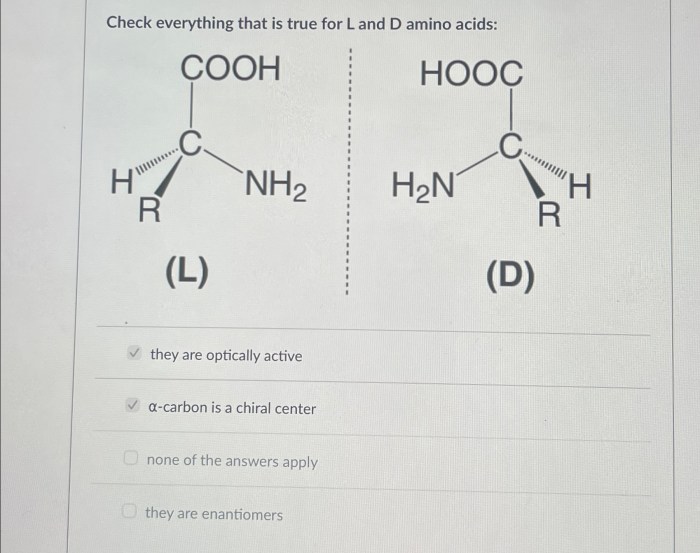
Di dunia biokimia yang kompleks, asam amino memainkan peran krusial sebagai blok bangunan protein. Sebagian besar asam amino bersifat kiral, artinya molekulnya memiliki bentuk tangan kanan dan tangan kiri yang berbeda dan memiliki aktivitas optik. Namun, ada satu pengecualian yang menarik: glisin. Keunikan glisin sebagai asam amino akiral memiliki implikasi signifikan terhadap struktur dan fungsi protein yang melibatkannya.
Struktur Kimia Glikosin
Glisin, asam amino paling sederhana, memiliki rumus kimia C2H5NO2. Struktur kimianya terdiri dari gugus amino (-NH2), gugus karboksil (-COOH), dan atom hidrogen (-H) yang terikat pada atom karbon α (karbon pusat). Yang membedakan glisin dari asam amino lainnya adalah gugus R-nya, yang hanya berupa atom hidrogen tunggal. Sederhananya, glisin hanya memiliki satu atom hidrogen sebagai rantai samping.
Alasan Glikosin Tidak Bersifat Optis Aktif
Sifat optis aktif suatu molekul bergantung pada keberadaan pusat kiral—atom karbon yang terikat pada empat gugus berbeda. Glisin tidak memiliki pusat kiral karena atom karbon α-nya terikat pada dua gugus hidrogen yang identik, selain gugus amino dan karboksil. Ketiadaan pusat kiral ini menyebabkan glisin tidak dapat memutar bidang cahaya terpolarisasi, sehingga bersifat akiral dan tidak memiliki isomer optik (enansiomer).
Asam amino yang tidak bersifat optis aktif adalah glisin, karena strukturnya simetris. Keunikan ini, sebagaimana pentingnya penyusunan sistematis dalam karya ilmiah – baca selengkapnya mengapa hal itu krusial di mengapa dalam penulisan karya ilmiah harus disusun secara sistematis – menunjukkan betapa detail struktural berpengaruh besar pada sifat molekul. Begitu pula, penyajian data yang terstruktur dalam penulisan ilmiah memudahkan pembaca memahami argumen dan kesimpulan.
Kembali ke topik utama, ketidakaktifan optik glisin ini menjadikannya pengecualian di antara asam amino lainnya.
Perbandingan Struktur Glikosin dengan Asam Amino Kiral
Berbeda dengan glisin, asam amino kiral lainnya memiliki gugus R yang beragam dan berbeda dari gugus amino, karboksil, dan hidrogen pada atom karbon α. Contohnya, alanin memiliki gugus metil (-CH3) sebagai gugus R, sementara serin memiliki gugus hidroksilmetil (-CH2OH). Keberadaan gugus R yang berbeda ini menciptakan pusat kiral pada atom karbon α, sehingga menghasilkan isomer D dan L yang bersifat optis aktif.
Gambaran Struktur 3D Glikosin dan Ketiadaan Pusat Kiral
Bayangkan struktur tiga dimensi glisin. Atom karbon α berada di pusat, dengan gugus amino, karboksil, dan dua atom hidrogen yang terikat padanya. Karena dua gugus hidrogen identik, tidak ada perbedaan orientasi spasial yang menghasilkan isomer. Struktur ini simetris terhadap atom karbon α, menunjukkan ketiadaan pusat kiral dan konfirmasi sifat akiralnya.
Asam amino yang tidak bersifat optis aktif adalah glisin, karena struktur molekulnya simetris. Keunikan glisin ini, sebagaimana keunikan setiap individu, mengingatkan kita pada pentingnya memahami perspektif orang lain; sebuah pemahaman yang sangat relevan dengan pertanyaan mendasar, mengapa kita harus menjadi pemaaf , karena memaafkan, seperti memahami struktur glisin, membutuhkan pengakuan akan kompleksitas dan kesederhanaan yang ada di dalamnya.
Kembali ke topik awal, sifat non-kiral glisin menunjukkan betapa keunikan kimiawi bisa mempengaruhi fungsi biologis, sebagaimana keunikan karakter manusia memengaruhi interaksi sosial kita.
Implikasi Ketiadaan Sifat Optis Aktif Glikosin terhadap Fungsinya dalam Tubuh
Ketiadaan sifat optis aktif glisin memberikan fleksibilitas struktural pada protein yang mengandungnya. Karena tidak memiliki isomer, glisin dapat dengan mudah berintegrasi ke dalam berbagai struktur protein, termasuk struktur yang memerlukan belokan tajam atau lipatan spesifik. Peran glisin yang penting dalam kolagen, misalnya, dipengaruhi oleh fleksibilitas ini. Selain itu, ukurannya yang kecil memungkinkan glisin untuk menempati ruang-ruang sempit dalam struktur protein yang kompleks, sehingga berperan penting dalam stabilitas dan fungsi protein tersebut.
Perbedaan Asam Amino Akiral dan Kiral dalam Biologi

Asam amino, blok bangunan protein, terbagi menjadi dua kelompok utama berdasarkan sifat optiknya: kiral dan akiral. Perbedaan ini, sekilas tampak sederhana, namun memiliki implikasi yang sangat signifikan terhadap struktur, fungsi, dan peran biologis protein. Memahami perbedaan ini penting untuk mengungkap kompleksitas kehidupan di tingkat molekuler.
Asam amino kiral, yang mayoritas ditemukan dalam sistem biologi, memiliki atom karbon asimetris (karbon kiral) yang terikat pada empat gugus berbeda. Kehadiran karbon kiral ini memungkinkan keberadaan dua isomer optik, yaitu enantiomer (L dan D), yang merupakan bayangan cermin satu sama lain dan memiliki sifat optis aktif, memutar cahaya terpolarisasi ke arah yang berbeda. Sebaliknya, asam amino akiral memiliki atom karbon yang terikat pada dua atau lebih gugus yang identik, sehingga tidak memiliki isomer optik dan tidak menunjukkan aktivitas optik.
Peran Asam Amino Kiral dan Akiral dalam Sintesis Protein
Dalam sintesis protein, hanya asam amino L-kiral yang digunakan oleh ribosom. Ketelitian ini memastikan bahwa protein yang dihasilkan memiliki struktur tiga dimensi yang tepat dan berfungsi dengan optimal. Penggunaan asam amino D-kiral akan menghasilkan protein dengan struktur dan fungsi yang berbeda, bahkan dapat menyebabkan disfungsi. Sementara itu, asam amino akiral, meskipun jumlahnya terbatas, dapat memainkan peran tertentu dalam beberapa proses biokimia, meskipun tidak secara langsung terlibat dalam pembentukan rantai polipeptida utama penyusun protein.
Pengaruh Sifat Optis Aktif terhadap Interaksi Asam Amino dalam Struktur Protein
Sifat optis aktif asam amino kiral sangat berpengaruh terhadap interaksi antar asam amino dalam struktur protein. Interaksi non-kovalen, seperti ikatan hidrogen dan interaksi van der Waals, sangat sensitif terhadap stereokimia asam amino. Konfigurasi L-kiral memungkinkan pembentukan ikatan hidrogen yang spesifik dan terarah, yang sangat penting dalam pelipatan protein menjadi struktur tiga dimensi yang unik dan fungsional. Asam amino akiral, karena tidak memiliki isomer optik, tidak memberikan kontribusi signifikan pada interaksi stereospesifik ini.
Asam amino yang tidak bersifat optis aktif adalah glisin, karena struktur molekulnya simetris. Ini berbeda dengan proses penemuan mesin cetak oleh Gutenberg, yang penuh lika-liku dan inovasi. Bagaimana ia berhasil menciptakan revolusi informasi tersebut, bisa Anda baca selengkapnya di sini: bagaimana gutenberg menemukan mesin cetak. Kembali ke topik utama, keunikan glisin sebagai satu-satunya asam amino tanpa aktivitas optik menunjukkan kompleksitas dasar biokimia, jauh berbeda dengan kompleksitas teknologi mesin cetak pertama di dunia.
Contoh Pengaruh Perbedaan Sifat Optis Aktif terhadap Fungsi Protein
Salah satu contoh nyata adalah enzim. Enzim, sebagai katalis biologis, memiliki sisi aktif yang sangat spesifik terhadap substrat. Spesifisitas ini sangat bergantung pada stereokimia asam amino yang menyusun sisi aktif. Jika asam amino D-kiral digunakan dalam sintesis enzim, sisi aktif akan berubah bentuk, sehingga substrat tidak dapat berikatan dan enzim kehilangan fungsinya. Perbedaan ini bahkan bisa berakibat fatal, seperti pada kasus racun tertentu yang memanfaatkan perbedaan stereokimia ini untuk mengganggu fungsi protein penting dalam tubuh.
Perbedaan Sifat Fisik dan Kimia Asam Amino Kiral dan Akiral
- Aktivitas Optik: Asam amino kiral bersifat optis aktif, memutar bidang polarisasi cahaya, sedangkan asam amino akiral tidak aktif secara optik.
- Isomerisme: Asam amino kiral memiliki dua enantiomer (L dan D), sedangkan asam amino akiral tidak memiliki isomer optik.
- Interaksi Stereospesifik: Asam amino kiral terlibat dalam interaksi stereospesifik, seperti pembentukan ikatan hidrogen yang spesifik, sedangkan asam amino akiral tidak.
- Peran dalam Sintesis Protein: Hanya asam amino L-kiral yang digunakan dalam sintesis protein.
- Kelarutan: Meskipun ada sedikit perbedaan, umumnya kelarutan keduanya dapat bervariasi tergantung pada gugus sampingnya.
Perbedaan utama antara asam amino kiral dan akiral terletak pada keberadaan atom karbon asimetris dan konsekuensinya terhadap aktivitas optik dan kemampuan berinteraksi secara stereospesifik. Sifat kiralitas ini esensial dalam menentukan struktur tiga dimensi dan fungsi protein dalam sistem biologi. Penggunaan asam amino L-kiral yang eksklusif dalam sintesis protein mencerminkan selektivitas dan ketelitian yang luar biasa dalam proses kehidupan.
Contoh Lain Senyawa Akiral selain Glikosin
Glisin, sebagai asam amino paling sederhana, memang tidak memiliki sifat optis aktif karena simetri molekulnya. Namun, ketidakaktifan optik ini bukanlah fenomena unik bagi glisin. Banyak senyawa lain dalam dunia biokimia juga menunjukkan karakteristik akiral. Memahami senyawa-senyawa ini penting untuk melengkapi pemahaman kita tentang keanekaragaman molekul dan fungsinya dalam sistem biologis.
Berikut ini akan dibahas dua contoh senyawa akiral yang relevan dalam konteks biokimia, menjelaskan mengapa mereka tidak bersifat optis aktif, menampilkan struktur kimianya, dan membandingkannya dengan glisin dalam konteks kiralitas dan kegunaannya. Perbedaan struktur dan sifat antara senyawa akiral dan asam amino kiral akan dijabarkan secara rinci.
Alanin dan Asam Asetat
Dua contoh senyawa akiral yang umum dijumpai dalam sistem biologis adalah alanin (dalam bentuk L-alanin) dan asam asetat. Meskipun alanin merupakan asam amino, isomer tertentu menunjukkan sifat akiral. Perbedaannya terletak pada struktur dan posisi gugus fungsi.
L-Alanin, secara umum bersifat kiral, tetapi jika kita mempertimbangkan bentuk racemiknya (campuran jumlah L-alanin dan D-alanin yang sama), maka sifat optis aktifnya akan hilang karena rotasi cahaya terpolarisasi oleh L-alanin akan dikompensasi oleh rotasi berlawanan arah dari D-alanin. Asam asetat, di sisi lain, secara inheren akiral karena strukturnya yang simetris.
Struktur Kimia dan Penjelasan Ketidakaktifan Optik
Struktur kimia alanin dan asam asetat memberikan gambaran jelas mengapa mereka tidak selalu bersifat optis aktif. L-alanin memiliki rumus kimia CH3CH(NH2)COOH. Keberadaan atom karbon asimetris (karbon kiral) yang terikat pada empat gugus berbeda membuat alanin, secara umum, bersifat kiral dan optis aktif. Namun, campuran racemik L-alanin dan D-alanin menghilangkan sifat optis aktifnya.
Rumus kimia asam asetat adalah CH3COOH. Molekul asam asetat simetris, tidak memiliki atom karbon asimetris, sehingga tidak memiliki isomer optik dan karenanya tidak aktif secara optik.
Struktur asam asetat yang sederhana dan simetris menyebabkan tidak adanya pusat kiral, sehingga ia tidak dapat memutar cahaya terpolarisasi. Hal ini berbeda dengan asam amino kiral yang memiliki atom karbon asimetris yang memungkinkan rotasi cahaya terpolarisasi.
Tabel Perbandingan Glisin, Alanin (Racemik), dan Asam Asetat
| Nama Senyawa | Rumus Kimia | Sifat Kiralitas | Kegunaan |
|---|---|---|---|
| Glisin | NH2CH2COOH | Akiral | Sintesis protein, neurotransmitter |
| Alanin (Racemik) | CH3CH(NH2)COOH | Akiral (campuran racemik) | Sintesis protein, suplemen nutrisi |
| Asam Asetat | CH3COOH | Akiral | Bahan pengawet makanan, sintesis berbagai senyawa kimia |
Perbedaan Struktur dan Sifat antara Senyawa Akiral dan Asam Amino Kiral
Perbedaan mendasar terletak pada keberadaan atom karbon asimetris. Asam amino kiral, seperti sebagian besar asam amino, memiliki atom karbon yang terikat pada empat gugus berbeda, menciptakan pusat kiral dan menghasilkan isomer optik. Senyawa akiral, seperti glisin, alanin racemik, dan asam asetat, tidak memiliki atom karbon asimetris, sehingga tidak menghasilkan isomer optik dan tidak menunjukkan aktivitas optik.
Perbedaan ini berdampak signifikan pada sifat fisik dan kimia senyawa. Asam amino kiral dapat memutar cahaya terpolarisasi, sedangkan senyawa akiral tidak. Perbedaan ini juga memiliki implikasi penting dalam interaksi biomolekul dan fungsi biologisnya.
Simpulan Akhir: Asam Amino Yang Tidak Bersifat Optis Aktif Adalah
Kesimpulannya, pemahaman tentang asam amino yang bersifat optis aktif dan tidak, khususnya glisin, merupakan kunci untuk mengungkap rahasia kompleksitas kehidupan. Ketiadaan sifat optis aktif pada glisin, akibat struktur kimianya yang unik, memiliki peran penting dalam berbagai proses biologi. Penelitian lebih lanjut di bidang ini akan terus mengungkap peran vital glisin dan senyawa akiral lainnya dalam mekanisme seluler dan keseluruhan fungsi organisme hidup. Ini membuka jalan bagi pengembangan teknologi dan terapi baru di masa depan.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya