BCl3 polar atau nonpolar? Pertanyaan ini menguak misteri di balik perilaku molekul sederhana namun penting ini. Struktur molekulnya, dengan geometri trigonal planar dan distribusi elektron yang unik, menjadi kunci untuk memahami sifat polaritasnya. Perbedaan elektronegativitas antara boron dan klorin membentuk ikatan polar, namun penataan spasial atom-atom dalam molekul menghasilkan efek yang mengejutkan. Memahami hal ini tak hanya penting dalam kimia dasar, namun juga berpengaruh pada sifat fisik BCl3, seperti titik didih, titik leleh, dan kelarutannya. Mari kita telusuri lebih dalam bagaimana struktur mikro memengaruhi sifat makro BCl3.
Analisis mendalam terhadap momen dipol ikatan B-Cl dan momen dipol keseluruhan molekul menjadi titik krusial. Perhitungan sederhana dan visualisasi struktur tiga dimensi akan mengungkap apakah molekul BCl3 secara keseluruhan bersifat polar atau nonpolar. Perbandingan dengan molekul trihalida boron lainnya, seperti BF3 dan BBr3, akan semakin memperjelas konsep polaritas molekul dan pengaruhnya terhadap sifat fisik. Lebih dari sekedar teori, pemahaman ini memiliki implikasi praktis dalam berbagai aplikasi industri dan penelitian.
Struktur Molekul BCl3: Bcl3 Polar Atau Nonpolar

Boron triklorida (BCl3) merupakan senyawa kimia yang menarik untuk dikaji, terutama dari sisi struktur molekulnya dan implikasi terhadap sifat polaritasnya. Pemahaman mendalam tentang geometri molekul dan distribusi elektron valensi krusial untuk menjelaskan mengapa BCl3 memiliki sifat-sifat unik. Mari kita telusuri lebih lanjut struktur molekul BCl3 ini.
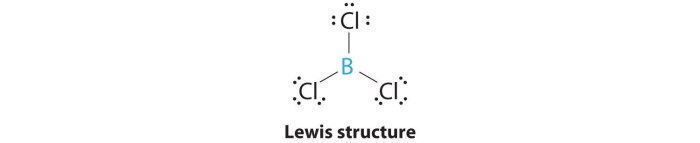
Struktur Lewis BCl3
Struktur Lewis BCl3 menggambarkan bagaimana atom-atom boron dan klorin terikat satu sama lain melalui elektron valensi. Boron, sebagai unsur golongan III A, memiliki tiga elektron valensi, sementara klorin, sebagai unsur golongan VII A, memiliki tujuh elektron valensi. Dalam BCl3, boron membentuk tiga ikatan kovalen tunggal dengan tiga atom klorin, sehingga setiap atom klorin berbagi satu elektron dengan atom boron. Representasi visualnya menunjukkan atom boron di tengah dikelilingi oleh tiga atom klorin, masing-masing terhubung dengan ikatan tunggal. Struktur ini menghasilkan molekul planar trigonal.
Polaritas Ikatan B-Cl
Boron triklorida (BCl3) merupakan senyawa kimia yang menarik untuk dikaji terkait polaritas ikatannya. Memahami polaritas ikatan B-Cl sangat krusial, karena hal ini menentukan sifat-sifat fisik dan kimia senyawa tersebut, termasuk titik didih, kelarutan, dan reaktivitasnya. Analisis ini akan menelisik lebih dalam perbedaan elektronegativitas antara Boron dan Klorin, serta implikasinya terhadap momen dipol ikatan B-Cl.
Sifat polar atau nonpolar BCl3 ditentukan oleh geometri molekulnya. Keelektronegatifan klor yang lebih tinggi daripada boron menciptakan ikatan polar, namun geometri trigonal planarnya menyebabkan momen dipol saling meniadakan, sehingga BCl3 bersifat nonpolar. Memahami konsep ini mirip dengan memahami apa itu keteladanan ; keduanya memerlukan pemahaman mendalam akan detail komponen penyusunnya untuk menghasilkan kesimpulan yang akurat.
Kembali ke BCl3, ketidakpolarannya mempengaruhi sifat fisik dan kimianya yang berbeda dari senyawa polar. Kesimpulannya, meskipun ikatannya polar, molekul BCl3 secara keseluruhan nonpolar.
Perbedaan Elektronegativitas Boron dan Klorin
Elektronegativitas merupakan ukuran kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Klorin (Cl) memiliki elektronegativitas yang jauh lebih tinggi daripada Boron (B). Perbedaan elektronegativitas yang signifikan ini menjadi kunci pemahaman polaritas ikatan B-Cl. Nilai elektronegativitas Klorin sekitar 3,16 sedangkan Boron hanya sekitar 2,04 pada skala Pauling. Selisih yang cukup besar ini mengindikasikan adanya distribusi elektron yang tidak merata dalam ikatan B-Cl.
Jenis Ikatan B-Cl: Polar atau Nonpolar?
Meskipun terdapat perbedaan elektronegativitas yang signifikan, ikatan B-Cl dikategorikan sebagai ikatan kovalen polar. Hal ini dikarenakan meskipun elektron lebih tertarik ke arah atom Klorin yang lebih elektronegatif, elektron tersebut tidak sepenuhnya berpindah ke Klorin sehingga tidak membentuk ikatan ionik. Adanya perbedaan muatan parsial (δ-) pada atom Klorin dan muatan parsial (δ+) pada atom Boron menghasilkan momen dipol.
Pengaruh Perbedaan Elektronegativitas terhadap Polaritas Ikatan B-Cl
Perbedaan elektronegativitas antara Boron dan Klorin menyebabkan elektron ikatan lebih tertarik ke atom Klorin. Akibatnya, atom Klorin memiliki muatan parsial negatif (δ-), sementara atom Boron memiliki muatan parsial positif (δ+). Distribusi muatan yang tidak merata ini menciptakan momen dipol, sebuah vektor yang menunjukkan arah dan besarnya pemisahan muatan. Semakin besar perbedaan elektronegativitas, semakin besar pula momen dipol, dan semakin polar ikatan tersebut.
BCl 3, bersifat nonpolar meski memiliki ikatan polar. Geometri molekulnya yang trigonal planar menyebabkan momen dipol ikatan saling meniadakan. Perdebatan mengenai kepolaran molekul ini, sekilas mengingatkan kita pada perdebatan seputar pemilihan pengganti Yudas Iskariot – sebuah proses yang juga kompleks dan melibatkan berbagai pertimbangan. Kembali ke BCl 3, pemahaman mengenai kepolaran molekul ini penting dalam berbagai aplikasi kimia, selayaknya pemahaman konteks sejarah pemilihan pengganti Yudas dalam memahami dinamika awal perkembangan Kekristenan.
Kesimpulannya, BCl 3 tetaplah nonpolar, sebagaimana proses sejarah punya konsekuensi yang tak bisa diabaikan begitu saja.
Konsep Momen Dipol dan Hubungannya dengan Polaritas Ikatan
Momen dipol (µ) didefinisikan sebagai hasil kali muatan (q) dan jarak pemisahan muatan (d). Rumusnya dapat ditulis sebagai µ = q × d. Momen dipol merupakan besaran vektor, yang berarti memiliki besar dan arah. Arah momen dipol mengarah dari muatan positif ke muatan negatif. Dalam ikatan B-Cl, momen dipol mengarah dari atom Boron ke atom Klorin. Semakin besar momen dipol, semakin polar ikatannya. Jika momen dipol sama dengan nol, maka ikatan tersebut bersifat nonpolar.
Perhitungan Momen Dipol Ikatan B-Cl
Perhitungan akurat momen dipol ikatan B-Cl membutuhkan data eksperimental yang spesifik. Namun, secara kualitatif, kita dapat menyimpulkan bahwa BCl3 memiliki momen dipol yang relatif kecil, meskipun ikatan B-Cl bersifat polar. Hal ini dikarenakan geometri molekul BCl3 yang planar trigonal, menyebabkan momen dipol dari ketiga ikatan B-Cl saling meniadakan satu sama lain. Meskipun setiap ikatan B-Cl bersifat polar, keseluruhan molekul BCl3 bersifat nonpolar karena resultan momen dipolnya adalah nol.
BCl3, senyawa kimia yang menarik, bersifat nonpolar karena distribusi elektronnya yang simetris. Konsep simetri ini, menariknya, mirip dengan prinsip keseimbangan dalam pendidikan, sesuatu yang ditekankan dalam pendidikan menurut alkitab , yang menekankan pengembangan karakter seimbang. Kembali ke BCl3, pemahaman sifat kepolarannya krusial dalam berbagai aplikasi, menunjukkan bagaimana pemahaman mendalam tentang detail, seperti dalam studi kimia, sejalan dengan prinsip pembelajaran yang holistik dan menyeluruh, seperti yang diajarkan dalam ajaran agama.
Sifat nonpolar BCl3 ini, pada akhirnya, menentukan perilakunya dalam reaksi kimia.
Polaritas Molekul BCl3
Boron triklorida (BCl3) merupakan senyawa kimia yang menarik untuk dikaji, khususnya terkait polaritasnya. Memahami polaritas molekul ini memberikan wawasan penting dalam sifat-sifat kimia dan fisiknya, serta perilakunya dalam berbagai reaksi. Analisis momen dipol, baik ikatan maupun molekul secara keseluruhan, menjadi kunci untuk mengungkap sifat polar atau nonpolar BCl3. Perbandingan dengan senyawa sejenis, seperti BF3 dan BBr3, akan semakin memperjelas pemahaman kita.
Momen Dipol Keseluruhan Molekul
Momen dipol merupakan besaran vektor yang menggambarkan pemisahan muatan positif dan negatif dalam suatu ikatan atau molekul. Dalam molekul BCl3, kita perlu memperhatikan momen dipol ikatan B-Cl dan bagaimana momen-momen dipol ini saling memengaruhi untuk menghasilkan momen dipol keseluruhan molekul. Jika momen dipol keseluruhan nol, molekul bersifat nonpolar. Sebaliknya, jika momen dipol keseluruhan tidak nol, molekul bersifat polar. Ini bergantung pada geometri molekul dan perbedaan elektronegativitas atom-atom penyusunnya.
Analisis Momen Dipol Ikatan B-Cl
Atom klor (Cl) lebih elektronegatif daripada atom boron (B). Akibatnya, dalam ikatan B-Cl, elektron ikatan lebih tertarik ke atom klor, menciptakan dipol ikatan dengan kutub negatif pada atom klor dan kutub positif pada atom boron. Namun, penting untuk mempertimbangkan geometri molekul BCl3 untuk menentukan polaritas keseluruhannya.
Polaritas BCl3 Berdasarkan Analisis Momen Dipol
BCl3 memiliki geometri molekul trigonal planar, dengan sudut ikatan sekitar 120°. Ketiga ikatan B-Cl memiliki momen dipol yang sama besar, tetapi arahnya saling berlawanan dan membentuk sudut 120° satu sama lain. Akibatnya, momen dipol ikatan B-Cl saling meniadakan. Dengan kata lain, vektor momen dipol masing-masing ikatan B-Cl saling menghilangkan efeknya, menghasilkan momen dipol keseluruhan molekul yang sama dengan nol. Oleh karena itu, BCl3 bersifat nonpolar.
Perbandingan Polaritas BCl3 dengan Trihalida Boron Lainnya, Bcl3 polar atau nonpolar
Sifat nonpolar BCl3 dapat dibandingkan dengan trihalida boron lainnya, seperti BF3 dan BBr3. Ketiga senyawa ini memiliki geometri molekul yang sama, yaitu trigonal planar. Perbedaannya terletak pada elektronegativitas halogen yang terikat pada boron. Meskipun momen dipol ikatan B-X (X = F, Cl, Br) ada, geometri planar menyebabkan peniadaan momen dipol tersebut, menghasilkan molekul nonpolar untuk ketiganya.
Tabel Perbandingan Polaritas BCl3, BF3, dan BBr3
| Senyawa | Geometri Molekul | Polaritas Ikatan B-X | Polaritas Molekul |
|---|---|---|---|
| BF3 | Trigonal Planar | Polar | Nonpolar |
| BCl3 | Trigonal Planar | Polar | Nonpolar |
| BBr3 | Trigonal Planar | Polar | Nonpolar |
Pengaruh Polaritas terhadap Sifat Fisik BCl3
Boron triklorida (BCl3), meskipun memiliki ikatan polar, merupakan molekul nonpolar. Ini adalah fakta yang seringkali mengejutkan, mengingat pentingnya memahami bagaimana struktur molekul menentukan sifat fisiknya. Pemahaman ini krusial, tidak hanya untuk BCl3 sendiri, tetapi juga untuk menganalisis senyawa-senyawa serupa dan memprediksi perilaku mereka dalam berbagai aplikasi. Sifat fisik BCl3, seperti titik didih dan kelarutan, sangat dipengaruhi oleh interaksi antarmolekul yang lemah akibat sifat nonpolarnya. Mari kita dalami lebih lanjut bagaimana polaritas (atau lebih tepatnya, nonpolaritas) BCl3 mempengaruhi sifat-sifatnya.
Titik Didih dan Titik Leleh BCl3
BCl3 memiliki titik didih yang relatif rendah (-12,5 °C) dan titik leleh yang juga rendah (-107 °C). Nilai-nilai ini mencerminkan lemahnya gaya antarmolekul dalam senyawa ini. Berbeda dengan senyawa polar yang memiliki gaya antarmolekul yang lebih kuat seperti ikatan hidrogen atau dipol-dipol, BCl3 hanya dipengaruhi oleh gaya London (gaya dispersi), yang merupakan gaya antarmolekul terlemah. Oleh karena itu, energi yang dibutuhkan untuk mengubah BCl3 dari padat ke cair, atau dari cair ke gas, relatif kecil, sehingga menghasilkan titik didih dan titik leleh yang rendah. Perbandingan dengan senyawa serupa yang memiliki momen dipol permanen akan menunjukkan perbedaan yang signifikan.
Kelarutan BCl3 dalam Pelarut Polar dan Nonpolar
Sifat nonpolar BCl3 mempengaruhi kelarutannya. BCl3 akan larut lebih baik dalam pelarut nonpolar daripada dalam pelarut polar. Hal ini karena prinsip “like dissolves like”—zat yang memiliki kepolaran yang sama cenderung saling melarutkan. Dalam pelarut nonpolar, interaksi antara molekul BCl3 dan molekul pelarut relatif lemah, sehingga memungkinkan BCl3 untuk bercampur dengan baik. Sebaliknya, dalam pelarut polar, interaksi yang kuat antara molekul pelarut akan menghambat pelarutan BCl3.
Pengaruh Polaritas BCl3 terhadap Interaksi Antarmolekul
Seperti yang telah disinggung sebelumnya, interaksi antarmolekul dalam BCl3 didominasi oleh gaya London. Gaya ini muncul karena fluktuasi sementara dalam distribusi elektron di sekitar molekul. Meskipun ikatan B-Cl bersifat polar, geometri planar trigonal dari molekul BCl3 menyebabkan momen dipol individu dari masing-masing ikatan B-Cl saling meniadakan, menghasilkan momen dipol total nol. Akibatnya, BCl3 berperilaku sebagai molekul nonpolar, dan interaksi antarmolekulnya relatif lemah dibandingkan dengan senyawa polar lainnya dengan berat molekul yang sebanding.
Hubungan antara Polaritas dan Sifat Fisik BCl3
Sifat fisik BCl3, seperti titik didih rendah dan kelarutan dalam pelarut nonpolar, merupakan konsekuensi langsung dari sifat nonpolarnya. Meskipun ikatan B-Cl bersifat polar, geometri molekul yang simetris menyebabkan momen dipol totalnya nol, sehingga menghasilkan interaksi antarmolekul yang lemah dan mempengaruhi sifat-sifat fisiknya secara signifikan.
Penggunaan BCl3 dalam Aplikasi Tertentu
Sifat-sifat unik BCl3, terutama reaktivitasnya dan titik didih yang rendah, memungkinkan penggunaannya dalam berbagai aplikasi. Sebagai contoh, BCl3 digunakan sebagai reagen dalam sintesis organik dan sebagai prekursor untuk pembuatan bahan semikonduktor. Sifat nonpolarnya juga memainkan peran penting dalam memilih pelarut yang tepat untuk reaksi-reaksi yang melibatkan BCl3. Pengetahuan tentang sifat fisik BCl3, yang saling terkait erat dengan polaritasnya, sangat penting untuk mengoptimalkan penggunaan dan efisiensi dalam berbagai aplikasi industri dan penelitian.
Ringkasan Akhir
Kesimpulannya, meskipun ikatan B-Cl dalam BCl3 bersifat polar, molekul BCl3 secara keseluruhan bersifat nonpolar. Ini disebabkan oleh penataan simetris atom-atom klorin di sekitar atom boron, sehingga momen dipol ikatan saling meniadakan. Pemahaman tentang polaritas molekul ini krusial, karena secara langsung mempengaruhi sifat fisik seperti titik didih, titik leleh, dan kelarutannya. Dengan demikian, BCl3 menjadi contoh menarik bagaimana struktur molekul menentukan sifat-sifat makroskopiknya, sebuah konsep dasar dalam kimia yang memiliki implikasi luas dalam berbagai bidang.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya