Emas termasuk zat, logam mulia yang telah memikat manusia selama berabad-abad. Keindahannya yang berkilau, kelangkaannya, dan sifat kimianya yang unik telah menjadikan emas sebagai komoditas berharga, kunci kemajuan teknologi, dan simbol kekayaan. Dari perhiasan mewah hingga sirkuit elektronik canggih, emas memainkan peran penting dalam berbagai aspek kehidupan modern. Namun, di balik kilauannya yang mempesona, terdapat proses pembentukan alami yang kompleks dan teknik ekstraksi yang rumit. Mari kita telusuri lebih dalam dunia emas, memahami sifat-sifatnya, kegunaannya, serta proses pembentukannya di bumi.
Sifat kimia emas yang inert, ketahanan terhadap korosi, dan konduktivitas listriknya yang tinggi menjadikannya bahan ideal untuk berbagai aplikasi. Emas murni, atau 24 karat, memiliki kemurnian tertinggi, sementara emas campuran (karat lebih rendah) dicampur dengan logam lain untuk meningkatkan kekuatan dan daya tahannya. Eksplorasi lebih lanjut akan mengungkap bagaimana sifat-sifat unik emas ini mendukung perannya dalam berbagai industri, dari perhiasan hingga kedokteran dan teknologi mutakhir. Perjalanan kita akan menyingkap rahasia emas, dari tambang hingga aplikasi inovatifnya.
Sifat Kimia Emas: Emas Termasuk Zat

Emas, simbol Au dan nomor atom 79, dikenal luas sebagai logam mulia yang berharga. Keunikannya terletak bukan hanya pada kilauannya yang memikat, tetapi juga pada sifat kimia yang membuatnya tahan terhadap korosi dan reaksi kimia umum. Pemahaman mendalam tentang sifat kimia emas krusial, baik dalam konteks pertambangan, pengolahan, hingga aplikasi teknologi mutakhir.
Reaktivitas Emas
Emas merupakan logam transisi yang relatif inert, artinya ia memiliki reaktivitas kimia yang rendah. Hal ini disebabkan oleh konfigurasi elektronnya yang stabil (5d106s1), yang membuatnya enggan berpartisipasi dalam reaksi redoks. Meskipun demikian, emas dapat bereaksi, meskipun dengan kondisi yang spesifik. Reaksi emas seringkali melibatkan pembentukan kompleks dengan ligan tertentu, memanfaatkan sifatnya yang mampu membentuk ikatan koordinasi.
Emas, sebagai unsur kimia dengan simbol Au, merupakan zat padat berkilau yang telah lama menjadi komoditas berharga. Perlu diingat, ketika kita melihat iklan emas, misalnya yang menjanjikan keuntungan fantastis, kita harus kritis. Pasalnya, iklan harus menyajikan informasi yang akurat dan transparan, termasuk detail kadar emas dan proses produksinya. Informasi yang tidak jujur dapat menyesatkan konsumen.
Oleh karena itu, pemahaman mendalam tentang emas sebagai zat kimia, dan bukan sekadar simbol kekayaan, sangat penting sebelum melakukan transaksi.
Bilangan Oksidasi Emas
Emas umumnya ditemukan dalam dua bilangan oksidasi utama: +1 (aurous) dan +3 (auric). Bilangan oksidasi +1 relatif kurang stabil dibandingkan +3. Reaksi-reaksi yang melibatkan emas seringkali melibatkan perubahan bilangan oksidasi ini, misalnya pada proses pelarutan emas dalam larutan aqua regia (campuran asam nitrat dan asam klorida).
Reaksi Emas terhadap Asam dan Basa
Emas tahan terhadap korosi oleh sebagian besar asam dan basa. Ia tidak bereaksi dengan asam kuat seperti asam sulfat dan asam nitrat pekat. Namun, emas dapat larut dalam aqua regia, sebuah campuran asam nitrat dan asam klorida pekat. Proses pelarutan ini menghasilkan pembentukan ion kompleks [AuCl4]–. Reaksi dengan basa umumnya juga tidak signifikan, kecuali pada kondisi yang sangat ekstrem dan spesifik.
Tabel Periodik dan Unsur Sejenis
Posisi emas dalam tabel periodik memberikan konteks yang lebih luas tentang sifat kimianya. Emas termasuk dalam golongan 11 (logam transisi), bersama dengan perak (Ag) dan tembaga (Cu). Ketiga logam ini memiliki kesamaan sifat, yaitu konduktivitas listrik dan panas yang tinggi, serta ketahanan terhadap korosi, meskipun derajatnya berbeda. Perbedaan reaktivitasnya mencerminkan perbedaan konfigurasi elektron dan pengaruh efek relativitas pada orbital elektron.
| Nama Unsur | Simbol | Nomor Atom | Reaktivitas dengan Asam |
|---|---|---|---|
| Emas | Au | 79 | Rendah, larut dalam aqua regia |
| Perak | Ag | 47 | Sedang, bereaksi dengan asam nitrat pekat |
| Tembaga | Cu | 29 | Tinggi, bereaksi dengan asam oksidator seperti asam nitrat |
Bentuk dan Keadaan Emas

Emas, logam mulia yang telah memikat manusia selama berabad-abad, hadir dalam berbagai bentuk dan keadaan, baik di alam maupun setelah melalui proses pengolahan manusia. Memahami beragam bentuk fisik emas ini krusial, baik untuk menilai kualitasnya, memahami aplikasinya dalam berbagai industri, hingga mengerti bagaimana sifat-sifat uniknya terbentuk dari struktur atomnya. Dari bentuknya yang paling murni hingga aplikasinya dalam teknologi mutakhir, emas menunjukkan fleksibilitas dan nilai yang tak terbantahkan.
Emas, sebagai unsur kimia, memiliki sifat-sifat fisika dan kimia unik. Perilaku konduktivitasnya, misalnya, berbeda jauh dengan senyawa ionik seperti garam dapur. Bicara soal garam dapur, ketahuilah bahwa garam dapur termasuk elektrolit , artinya larutannya dapat menghantarkan arus listrik karena terdisosiasi menjadi ion. Sifat ini berbanding terbalik dengan sifat emas yang cenderung inert dan bukan elektrolit.
Kembali ke emas, keunikan sifat inilah yang membuatnya berharga dan banyak digunakan dalam berbagai aplikasi, mulai dari perhiasan hingga teknologi.
Bentuk Fisik Emas di Alam dan Hasil Pengolahan
Di alam, emas umumnya ditemukan dalam bentuk bijih, tercampur dengan mineral lain. Proses ekstraksi yang kompleks diperlukan untuk memisahkan emas dari mineral pengotor ini. Setelah diekstraksi, emas dapat diolah menjadi berbagai bentuk, mulai dari batangan (ingot) yang umum kita kenal hingga serbuk halus yang digunakan dalam berbagai aplikasi industri dan teknologi. Bentuk-bentuk lain termasuk lembaran tipis (foil), kawat, dan berbagai bentuk perhiasan. Proses pengolahan juga menghasilkan emas dalam bentuk larutan, misalnya dalam proses penyepuhan atau elektroplating.
Perbedaan Emas Murni dan Emas Campuran
Emas murni, atau emas 24 karat, merupakan emas dengan kemurnian 99,9%. Sifatnya yang sangat lunak membuat emas murni kurang praktis untuk penggunaan sehari-hari, terutama dalam pembuatan perhiasan. Oleh karena itu, emas sering dicampur dengan logam lain seperti perak, tembaga, atau nikel untuk meningkatkan kekerasan dan daya tahannya. Campuran ini menghasilkan emas dengan karat yang lebih rendah, misalnya emas 18 karat (75% emas murni) atau emas 14 karat (58,5% emas murni). Semakin tinggi karat emas, semakin tinggi pula kandungan emas murni di dalamnya.
Penerapan Emas dalam Berbagai Bentuk
Fleksibelitas emas memungkinkan penggunaannya dalam berbagai bentuk dan aplikasi. Sebagai contoh, emas padat digunakan dalam perhiasan, koin, dan batangan investasi. Emas serbuk digunakan dalam industri elektronik, sebagai konduktor listrik yang sangat baik. Emas dalam bentuk larutan digunakan dalam proses penyepuhan, memberikan lapisan emas tipis pada permukaan logam lain untuk meningkatkan penampilan dan daya tahannya. Dalam dunia medis, emas koloid digunakan dalam pengobatan tertentu. Kemampuan emas untuk menghantarkan panas dan listrik juga membuatnya sangat berharga dalam teknologi.
Emas, sebagai unsur kimia dengan simbol Au dan nomor atom 79, termasuk zat padat pada suhu ruang. Sifatnya yang lunak dan mudah ditempa membuatnya ideal untuk berbagai aplikasi, dari perhiasan hingga komponen elektronik. Perlu diketahui, pemahaman mendalam tentang sifat-sifat material seperti emas ini, serupa dengan kompleksitas memahami sistem guru wilangan gambuh dalam seni karawitan Jawa, membutuhkan studi yang cermat.
Kembali ke emas, keunikannya sebagai zat mulia juga tercermin dari daya tahannya terhadap korosi, membuatnya tetap berkilau selama berabad-abad.
Proses Pembuatan Emas Koloid
Proses pembuatan emas koloid melibatkan reduksi senyawa emas (seperti asam kloroaurat) menggunakan reduktor yang sesuai, seperti natrium sitrat. Reaksi ini menghasilkan partikel emas berukuran nano yang terdispersi dalam suatu larutan. Ukuran partikel emas koloid yang sangat kecil inilah yang memberikan sifat-sifat optik unik, misalnya warna merah ruby yang khas. Pengendalian parameter reaksi seperti konsentrasi reaktan, suhu, dan pH sangat penting untuk mendapatkan ukuran dan sifat partikel emas koloid yang diinginkan.
Struktur Atom Emas dan Pengaruhnya terhadap Sifat Fisik, Emas termasuk zat
Emas memiliki struktur kristal kubus berpusat muka (face-centered cubic atau FCC). Susunan atom dalam struktur FCC ini memberikan kontribusi signifikan terhadap sifat fisik emas, termasuk keuletan, kekerasan, dan kemampuannya untuk menghantarkan listrik dan panas dengan sangat baik. Elektron valensi emas yang relatif longgar memungkinkan pergerakan elektron bebas yang tinggi, yang menjelaskan sifat konduktivitasnya yang unggul. Interaksi antar atom dalam struktur FCC juga menentukan sifat keuletan dan kemudahan emas untuk ditempa dan dibentuk.
Kegunaan Emas
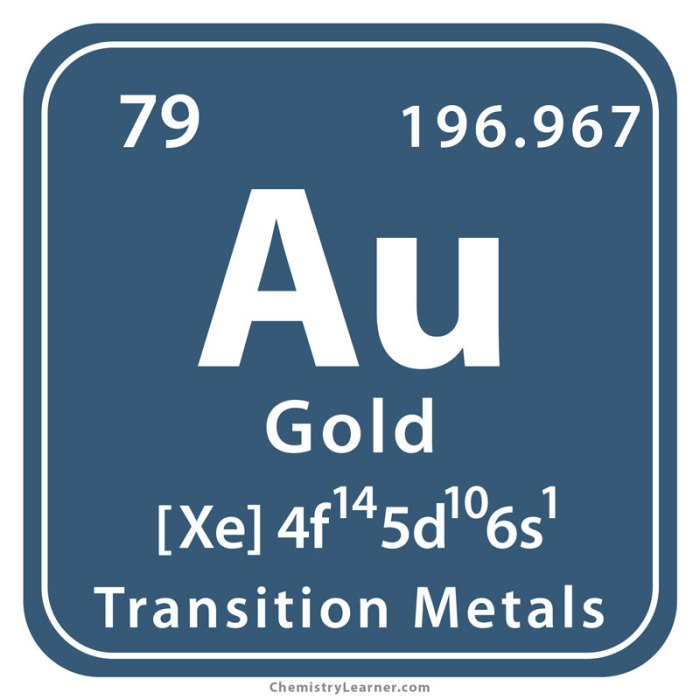
Emas, logam mulia yang telah memikat manusia selama berabad-abad, bukan sekadar simbol kekayaan dan status. Sifat-sifat uniknya—ketahanan terhadap korosi, konduktivitas listrik dan panas yang tinggi, serta kelenturannya—membuatnya menjadi bahan penting dalam berbagai industri. Dari perhiasan yang menghiasi tubuh hingga komponen canggih dalam teknologi modern, emas memainkan peran krusial yang terus berkembang seiring kemajuan zaman. Peran emas yang beragam ini mencerminkan nilai intrinsiknya yang melampaui sekadar nilai moneter.
Penggunaan Emas dalam Industri Perhiasan
Industri perhiasan merupakan pengguna emas terbesar. Keindahan, kilau, dan sifatnya yang tahan lama menjadikan emas pilihan utama untuk menciptakan perhiasan yang bernilai seni tinggi dan tahan lama. Proses pembuatan perhiasan emas melibatkan berbagai teknik, mulai dari penempaan hingga permata-permata yang diukir dengan presisi. Kualitas emas yang digunakan, kadarnya (misalnya 24 karat, 18 karat, dll.), dan desainnya menentukan harga dan nilai sebuah perhiasan. Popularitas emas dalam perhiasan juga dipengaruhi oleh faktor budaya dan tren mode yang terus berubah.
- Cincin kawin dan perhiasan pernikahan, simbol ikatan abadi.
- Kalung, gelang, dan anting-anting, aksesoris yang mempercantik penampilan.
- Liontin dan bros, perhiasan yang seringkali memiliki nilai sentimental.
Emas dalam Bidang Elektronika dan Teknologi
Konduktivitas listrik dan panas emas yang luar biasa, serta ketahanannya terhadap korosi, menjadikannya bahan penting dalam industri elektronika dan teknologi. Emas digunakan dalam berbagai komponen elektronik berukuran mikro, memastikan koneksi yang andal dan tahan lama, bahkan dalam kondisi lingkungan yang keras. Penggunaan emas dalam teknologi canggih memastikan kinerja optimal dan umur pakai yang panjang.
- Kontak listrik pada konektor dan sirkuit terpadu (IC).
- Lapisan tipis pada konektor dan komponen elektronik untuk mencegah korosi dan oksidasi.
- Komponen dalam perangkat medis implantable, membutuhkan ketahanan dan biokompatibilitas.
Peran Emas dalam Kedokteran dan Farmasi
Meskipun kurang umum dibandingkan penggunaan emas dalam perhiasan atau elektronik, emas juga memiliki aplikasi dalam bidang kedokteran dan farmasi. Sifat anti-inflamasi dan kemampuannya untuk membunuh bakteri tertentu telah menarik perhatian para peneliti. Namun, penggunaannya masih dalam tahap penelitian dan pengembangan, dengan beberapa aplikasi yang sudah mulai diterapkan.
- Penggunaan dalam pengobatan kanker, khususnya dalam terapi radiasi, sebagai agen kontras untuk pencitraan medis.
- Sebagai bahan untuk pembuatan implan medis tertentu, memanfaatkan sifat biokompatibilitasnya.
- Dalam beberapa pengobatan tradisional, emas digunakan sebagai anti-inflamasi meskipun masih memerlukan riset lebih lanjut.
Emas dalam Sistem Periodik
Emas, logam mulia yang telah memikat manusia selama ribuan tahun, memiliki tempat yang unik dalam sistem periodik unsur. Pemahaman posisi emas dalam tabel periodik ini tidak hanya penting untuk memahami sifat-sifat kimianya, tetapi juga untuk menjelaskan mengapa emas begitu berharga dan memiliki aplikasi yang luas, mulai dari perhiasan hingga teknologi canggih. Analisis terhadap tren periodik mengungkapkan hubungan yang menarik antara konfigurasi elektron emas dan perilaku kimianya yang khas.
Letak Emas dalam Tabel Periodik
Emas (Au) terletak pada periode 6, golongan 11 dalam tabel periodik unsur. Golongan 11 dikenal sebagai golongan logam transisi, yang dicirikan oleh elektron valensi yang berada pada subkulit d. Posisi emas ini menentukan sifat-sifat uniknya, membedakannya dari unsur-unsur lain di sekitarnya.
Perbandingan Emas dengan Unsur Lain
Sebagai logam transisi, emas memiliki kemiripan dan perbedaan dengan unsur-unsur lain dalam golongan dan periodenya. Misalnya, dibandingkan dengan perak (Ag) dan tembaga (Cu) yang juga berada dalam golongan 11, emas menunjukkan ketahanan terhadap korosi yang lebih tinggi. Namun, ketiga unsur ini memiliki titik leleh yang relatif rendah dibandingkan dengan logam transisi lain di periode yang sama. Perbedaan ini muncul dari konfigurasi elektron dan interaksi antar atom mereka.
Tren Sifat Periodik Emas
Tren sifat periodik seperti jari-jari atom, energi ionisasi, dan elektronegativitas menunjukkan pola yang sistematis di sepanjang periode dan golongan. Emas, dengan jari-jari atom yang relatif besar, memiliki energi ionisasi yang rendah dibandingkan dengan unsur-unsur di sebelah kanannya dalam periode yang sama. Elektronegativitas emas juga relatif rendah, menunjukkan kecenderungannya untuk melepaskan elektron daripada menariknya. Perilaku ini berkontribusi pada sifat kimia emas yang khas, misalnya sifatnya yang inert dan ketahanan terhadap oksidasi.
Ilustrasi Posisi Emas dan Unsur Sejenis
Bayangkan tabel periodik sebagai peta, dengan emas berada di lokasi spesifik. Di sekitarnya terdapat perak (Ag) dan tembaga (Cu) dalam golongan yang sama, menunjukkan kemiripan dalam sifat-sifat seperti konduktivitas listrik dan panas yang tinggi. Namun, emas berbeda karena ketahanannya terhadap korosi yang jauh lebih tinggi. Sementara itu, unsur-unsur di periode yang sama, seperti platinum (Pt) dan iridium (Ir), menunjukkan sifat yang berbeda, seperti titik leleh yang lebih tinggi dan sifat katalitik yang lebih kuat. Perbedaan ini muncul dari perbedaan konfigurasi elektron dan interaksi antar atom.
| Unsur | Golongan | Periode | Jari-jari Atom (pm) | Energi Ionisasi (kJ/mol) | Elektronegativitas |
|---|---|---|---|---|---|
| Tembaga (Cu) | 11 | 4 | 128 | 745 | 1.9 |
| Perak (Ag) | 11 | 5 | 144 | 731 | 1.9 |
| Emas (Au) | 11 | 6 | 144 | 890 | 2.4 |
Hubungan Konfigurasi Elektron dan Sifat Kimia Emas
Konfigurasi elektron emas adalah [Xe] 4f14 5d10 6s1. Elektron 6s1 yang relatif mudah dilepaskan berkontribusi pada sifat-sifat kimia emas, seperti kemampuannya untuk membentuk ion Au+ dan Au3+. Subkulit d yang terisi penuh (5d10) juga memberikan stabilitas ekstra, menjelaskan ketahanan emas terhadap korosi dan reaktivitas kimianya yang relatif rendah. Struktur elektron ini menentukan sifat-sifat emas yang membuatnya begitu berharga dan unik.
Proses Pembentukan Emas
Emas, logam mulia yang telah lama memikat manusia, terbentuk melalui proses geologi yang kompleks dan berlangsung selama jutaan tahun. Perjalanan emas dari perut bumi hingga menjadi perhiasan atau aset investasi melibatkan tahapan yang menarik untuk dikaji, mulai dari pembentukannya di kedalaman bumi hingga proses ekstraksi dan pemurnian yang rumit.
Pembentukan Emas Secara Alami
Emas terbentuk terutama melalui proses magmatik, di mana magma yang kaya akan emas mendingin dan mengkristal di dalam kerak bumi. Proses ini menghasilkan endapan emas primer yang sering ditemukan dalam batuan beku seperti granit dan diorit. Selain itu, emas juga terbentuk melalui proses hidrotermal, di mana air panas yang kaya mineral melarutkan emas dari batuan sekitarnya dan mengendapkannya di celah-celah batuan atau dalam urat-urat kuarsa. Proses pelapukan dan erosi selanjutnya memindahkan emas ini ke endapan sekunder di sungai dan aluvial, membentuk endapan emas plaser yang sering menjadi target penambangan tradisional.
Ekstraksi Emas dari Bijih
Ekstraksi emas dari bijihnya merupakan proses yang kompleks dan membutuhkan teknologi yang canggih. Secara umum, proses ini diawali dengan penghancuran batuan bijih menjadi ukuran yang lebih kecil. Kemudian, emas dipisahkan dari batuan menggunakan berbagai metode, seperti metode sianidasi, amalgamasi, atau gravitasi. Metode sianidasi, misalnya, menggunakan larutan sianida untuk melarutkan emas dari bijih. Setelah itu, emas yang telah terlarut dipisahkan dan dimurnikan.
Metode Pemurnian Emas
Setelah diekstraksi, emas masih mengandung sejumlah pengotor. Pemurnian emas bertujuan untuk menghilangkan pengotor tersebut dan meningkatkan kemurnian emas hingga mencapai kadar tertentu, misalnya 24 karat. Metode pemurnian yang umum digunakan antara lain elektrorefining, yang menggunakan proses elektrolisis untuk memisahkan emas dari pengotornya. Metode lain termasuk pemurnian asam dan pemurnian dengan cara peleburan. Proses ini menghasilkan emas dengan kemurnian tinggi yang siap untuk berbagai aplikasi.
Bagan Alur Proses Pengolahan Emas
| Tahap | Penjelasan Singkat |
|---|---|
| Penambangan | Penggalian bijih emas dari perut bumi. |
| Pengolahan Awal | Penghancuran dan penggilingan bijih untuk memisahkan emas dari batuan pengotor. |
| Ekstraksi | Pemisahan emas dari bijih menggunakan metode seperti sianidasi atau amalgamasi. |
| Pemurnian | Penghilangan pengotor dari emas untuk meningkatkan kemurnian. |
| Peleburan | Peleburan emas untuk membentuk batangan emas. |
| Pengujian dan Sertifikasi | Pengujian kemurnian emas dan pemberian sertifikat. |
Dampak Lingkungan Penambangan Emas
Penambangan emas, meskipun menghasilkan keuntungan ekonomi yang signifikan, seringkali menimbulkan dampak lingkungan yang serius. Penggunaan bahan kimia seperti sianida dalam proses ekstraksi dapat mencemari air dan tanah, mengancam kesehatan manusia dan ekosistem. Aktivitas penambangan juga dapat menyebabkan kerusakan habitat, erosi tanah, dan perubahan aliran sungai. Penting untuk menerapkan praktik penambangan yang bertanggung jawab dan berkelanjutan untuk meminimalkan dampak negatif terhadap lingkungan. Studi kasus di beberapa wilayah menunjukkan bahwa dampak jangka panjang penambangan emas terhadap lingkungan dan masyarakat sekitar sangat signifikan dan perlu penanganan serius.
Terakhir
Perjalanan kita menelusuri dunia emas telah mengungkap kekayaan pengetahuan tentang sifat kimia, bentuk fisik, kegunaan, dan proses pembentukannya. Dari sifatnya yang inert hingga aplikasinya yang luas, emas membuktikan dirinya sebagai logam mulia yang luar biasa. Memahami proses ekstraksi dan pemurnian emas juga penting untuk menyadari dampak lingkungannya dan mendorong praktik penambangan yang berkelanjutan. Kilauan emas bukan hanya sekadar keindahan estetika, tetapi juga cerminan dari kemajuan teknologi dan inovasi manusia. Dengan pemahaman yang lebih mendalam, kita dapat menghargai lebih lagi nilai dan peran emas dalam kehidupan kita.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya