Etanol termasuk elektrolit? Pernyataan ini mungkin terdengar mengejutkan, mengingat bayangan kita tentang elektrolit seringkali tertuju pada asam kuat atau basa kuat yang mampu menghantarkan listrik dengan efisien. Namun, kenyataannya lebih kompleks. Etanol, meskipun lemah, memiliki kemampuan konduktivitas listrik, walaupun jauh lebih rendah dibandingkan elektrolit kuat. Sifat polarnya, yang memungkinkan interaksi dengan molekul air, berperan penting dalam perilaku ini. Memahami sifat kimia etanol, termasuk gugus fungsi dan ikatan kimianya, crucial untuk mengungkap perilaku konduktivitasnya yang unik. Analisis mendalam tentang bagaimana etanol melarutkan berbagai zat, serta perbandingannya dengan elektrolit lain, akan mengungkap misteri di balik kemampuan konduktivitasnya yang relatif lemah.
Sifat unik etanol sebagai pelarut menjadi kunci dalam memahami perilakunya sebagai konduktor listrik yang lemah. Kemampuannya melarutkan berbagai zat, baik polar maupun nonpolar, tergantung pada interaksi antarmolekul. Etanol, dengan gugus hidroksil (-OH), mampu membentuk ikatan hidrogen dengan air dan zat terlarut polar lainnya. Namun, bagian nonpolarnya (rantai karbon) juga mempengaruhi kelarutannya. Pengaruh konsentrasi etanol pada kelarutan suatu zat juga menjadi faktor penting yang perlu dipertimbangkan. Dengan memahami faktor-faktor ini, kita dapat mengapresiasi kompleksitas perilaku etanol dalam berbagai sistem, termasuk sistem elektrokimia.
Sifat Kimia Etanol
Etanol, senyawa organik sederhana dengan rumus kimia C2H5OH, merupakan komponen kunci dalam berbagai industri, mulai dari minuman hingga bahan bakar. Pemahaman mendalam tentang sifat kimianya krusial untuk mengeksplorasi potensi dan aplikasinya yang luas. Sifat polar dan nonpolarnya, serta kemampuannya membentuk ikatan hidrogen, mempengaruhi kelarutan dan reaktivitasnya. Artikel ini akan mengupas tuntas aspek-aspek kimiawi etanol, membandingkannya dengan senyawa organik sejenis, dan memberikan gambaran komprehensif tentang karakteristiknya.
Polaritas dan Nonpolaritas Etanol
Molekul etanol menampilkan dualitas menarik: bagian polar dan nonpolar. Gugus hidroksil (-OH) bersifat polar karena perbedaan elektronegativitas antara oksigen dan hidrogen, menciptakan dipol permanen. Sebaliknya, gugus etil (-CH2CH3) bersifat nonpolar karena ikatan C-H memiliki perbedaan elektronegativitas yang kecil. Sifat amfipatik ini—memiliki bagian polar dan nonpolar—menentukan perilaku etanol dalam berbagai pelarut.
Ikatan Kimia dalam Molekul Etanol
Etanol memiliki ikatan kovalen, yaitu ikatan yang terbentuk melalui pemakaian bersama pasangan elektron antar atom. Ikatan C-C dan C-H dalam gugus etil bersifat nonpolar, sementara ikatan O-H dalam gugus hidroksil bersifat polar karena perbedaan elektronegativitas yang signifikan antara oksigen dan hidrogen. Ikatan O-H inilah yang memungkinkan etanol membentuk ikatan hidrogen, salah satu interaksi antarmolekul yang kuat.
Gugus Fungsi dan Pengaruhnya terhadap Sifat Etanol
Gugus fungsi utama dalam etanol adalah gugus hidroksil (-OH), yang menentukan sifat-sifat kimianya yang khas. Keberadaan gugus hidroksil ini menyebabkan etanol memiliki titik didih yang relatif tinggi dibandingkan dengan senyawa hidrokarbon dengan berat molekul yang sama. Hal ini disebabkan oleh adanya ikatan hidrogen antar molekul etanol. Gugus hidroksil juga bertanggung jawab atas kelarutan etanol dalam air.
Perbandingan Sifat Etanol dengan Senyawa Organik Lain, Etanol termasuk elektrolit
Tabel berikut membandingkan sifat etanol dengan beberapa senyawa organik lain yang memiliki gugus fungsi serupa, menunjukkan bagaimana perbedaan gugus fungsi dapat memengaruhi kelarutan dalam air.
| Nama Senyawa | Rumus Kimia | Gugus Fungsi | Kelarutan dalam Air |
|---|---|---|---|
| Etanol | C2H5OH | -OH (hidroksil) | Larut |
| Metanol | CH3OH | -OH (hidroksil) | Larut |
| Etanal | CH3CHO | -CHO (aldehida) | Sedikit larut |
| Asam Asetat | CH3COOH | -COOH (karboksil) | Larut |
Kemampuan Etanol Membentuk Ikatan Hidrogen dengan Air
Etanol mampu membentuk ikatan hidrogen dengan air karena adanya gugus hidroksil (-OH) yang polar. Atom oksigen dalam gugus hidroksil etanol dapat membentuk ikatan hidrogen dengan atom hidrogen dalam molekul air, dan sebaliknya. Kemampuan ini menjelaskan kelarutan etanol yang tinggi dalam air. Sebagai perbandingan, hidrokarbon seperti heksana yang tidak memiliki gugus hidroksil, tidak dapat membentuk ikatan hidrogen dengan air dan karenanya tidak larut dalam air. Interaksi kuat ini menghasilkan campuran homogen etanol dan air dalam berbagai proporsi.
Etanol sebagai Larutan
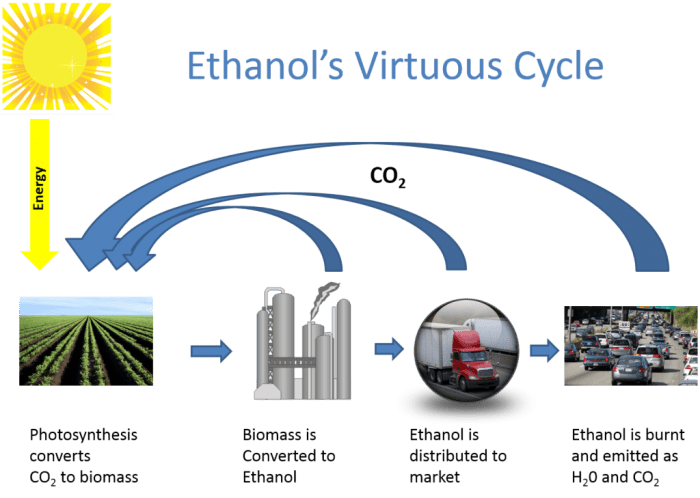
Etanol, atau alkohol etil, lebih dari sekadar komponen minuman beralkohol. Sifat kimiawinya yang unik membuatnya menjadi pelarut yang efektif dalam berbagai aplikasi, dari industri farmasi hingga produksi bahan bakar alternatif. Kemampuan etanol melarutkan berbagai zat ditentukan oleh interaksi antarmolekul antara etanol dan zat terlarut, sebuah proses yang kompleks dan menarik untuk dikaji.
Kemampuan Etanol Melarutkan Berbagai Zat
Etanol memiliki sifat polar dan nonpolar, membuatnya mampu melarutkan berbagai jenis zat. Bagian polar molekul etanol, gugus hidroksil (-OH), berinteraksi dengan zat polar melalui ikatan hidrogen. Sementara bagian nonpolar, rantai karbonnya, berinteraksi dengan zat nonpolar melalui gaya Van der Waals. Keduanya memungkinkan etanol melarutkan zat yang beragam, baik polar maupun nonpolar, meskipun cenderung lebih efektif melarutkan zat polar.
Contoh Zat yang Larut dan Tidak Larut dalam Etanol
Beberapa zat mudah larut dalam etanol, sementara yang lain tidak. Perbedaan ini didasarkan pada polaritas dan interaksi antarmolekul. Berikut beberapa contohnya:
- Larut: Air (polar), gula (polar), banyak senyawa organik seperti asam asetat dan ester.
- Tidak Larut: Minyak (nonpolar), lemak (nonpolar), beberapa garam anorganik.
Penting untuk diingat bahwa kelarutan merupakan sifat kuantitatif dan bergantung pada suhu dan tekanan.
Proses Pelarutan Suatu Zat dalam Etanol
Proses pelarutan zat dalam etanol dapat divisualisasikan melalui diagram alir berikut:
- Zat terlarut ditambahkan ke dalam etanol.
- Molekul etanol berinteraksi dengan molekul zat terlarut melalui ikatan hidrogen atau gaya Van der Waals.
- Interaksi ini mengatasi gaya tarik-menarik antar molekul zat terlarut.
- Molekul zat terlarut terdispersi di antara molekul etanol, membentuk larutan homogen.
Proses ini berlangsung hingga mencapai kesetimbangan, di mana laju pelarutan sama dengan laju pengendapan (jika terjadi).
Pengaruh Konsentrasi Etanol terhadap Kelarutan Suatu Zat
Konsentrasi etanol berpengaruh signifikan terhadap kelarutan suatu zat. Pada konsentrasi etanol tinggi, kelarutan zat polar cenderung meningkat karena lebih banyak gugus hidroksil tersedia untuk berinteraksi. Sebaliknya, kelarutan zat nonpolar mungkin berkurang karena efek polaritas etanol menjadi lebih dominan. Sebagai contoh, kelarutan minyak dalam campuran air-etanol akan meningkat seiring dengan peningkatan konsentrasi etanol, karena interaksi nonpolar antara etanol dan minyak menjadi lebih kuat.
Perbedaan Polaritas antara Etanol dan Zat Terlarut
Perbedaan polaritas antara etanol dan zat terlarut merupakan faktor penentu utama dalam proses pelarutan. “Like dissolves like” adalah prinsip umum yang berlaku. Zat polar cenderung larut dalam pelarut polar, sementara zat nonpolar larut dalam pelarut nonpolar. Etanol, sebagai pelarut amfifilik (memiliki bagian polar dan nonpolar), mampu melarutkan berbagai jenis zat, namun efisiensi pelarutan akan optimal ketika polaritas zat terlarut mendekati polaritas etanol.
Konduktivitas Etanol

Etanol, senyawa organik yang akrab kita temui dalam minuman beralkohol dan berbagai produk industri, memiliki sifat kelistrikan yang menarik untuk dikaji. Berbeda dengan logam yang merupakan konduktor listrik yang baik, etanol menunjukkan perilaku yang unik dalam menghantarkan arus listrik. Pemahaman tentang konduktivitas etanol penting dalam berbagai aplikasi, mulai dari pengembangan baterai hingga pemahaman proses kimia di dalam sel makhluk hidup.
Kemampuan Etanol Menghantarkan Arus Listrik
Etanol (C2H5OH) merupakan senyawa kovalen, artinya ikatan antar atomnya terbentuk melalui pemakaian bersama pasangan elektron. Berbeda dengan senyawa ionik yang terdisosiasi menjadi ion-ion bermuatan dalam larutan, etanol tidak terionisasi secara signifikan dalam keadaan murni. Hal ini menyebabkan etanol murni memiliki konduktivitas listrik yang sangat rendah, hampir mendekati isolator. Artinya, kemampuannya untuk menghantarkan arus listrik sangat terbatas.
Perbandingan Konduktivitas Etanol dan Air Murni
Air murni, meskipun juga memiliki konduktivitas yang rendah, memiliki konduktivitas yang lebih tinggi daripada etanol murni. Hal ini disebabkan oleh sedikitnya autoionisasi air, di mana molekul air terurai menjadi ion hidronium (H3O+) dan ion hidroksida (OH–). Meskipun jumlah ion ini sangat kecil, cukup untuk memberikan konduktivitas yang lebih besar daripada etanol murni. Perbedaan konduktivitas ini menjadi dasar mengapa air murni masih dapat sedikit menghantarkan arus listrik, sedangkan etanol murni hampir tidak.
Eksperimen Sederhana Pengujian Konduktivitas Etanol
Untuk menguji konduktivitas etanol, kita dapat menggunakan alat sederhana berupa lampu LED dan dua elektroda yang terhubung ke sumber tegangan rendah (misalnya, baterai 9V). Elektroda dicelupkan ke dalam sampel etanol. Jika lampu LED menyala, itu menandakan adanya konduktivitas. Namun, dengan etanol murni, lampu LED kemungkinan besar tidak akan menyala. Untuk membandingkan, uji coba dapat diulang dengan menggunakan air suling. Hasil yang diharapkan adalah lampu LED akan menyala lebih terang pada air suling dibandingkan dengan etanol murni. Perbedaan kecerahan lampu menunjukkan perbedaan konduktivitas.
Faktor-faktor yang Mempengaruhi Konduktivitas Etanol
- Kemurnian Etanol: Kehadiran ion-ion terlarut dalam etanol, misalnya dari garam atau asam, akan meningkatkan konduktivitasnya secara signifikan. Etanol murni yang bebas dari kontaminan akan memiliki konduktivitas yang sangat rendah.
- Suhu: Meningkatnya suhu akan meningkatkan mobilitas ion-ion dalam larutan, sehingga meningkatkan konduktivitas. Namun, efek ini relatif kecil pada etanol.
- Konsentrasi Zat Terlarut: Penambahan zat terlarut yang terionisasi, seperti asam atau basa kuat, akan meningkatkan jumlah ion dalam larutan, sehingga meningkatkan konduktivitas etanol.
Ilustrasi Deskriptif Kontribusi Ion terhadap Konduktivitas Etanol
Bayangkan larutan etanol yang mengandung sedikit garam terlarut. Garam ini akan terdisosiasi menjadi ion-ion positif dan negatif. Ketika medan listrik diterapkan pada larutan, ion-ion bermuatan ini akan bergerak; ion positif menuju kutub negatif dan ion negatif menuju kutub positif. Gerakan ion-ion inilah yang membawa muatan listrik dan menghasilkan arus listrik. Semakin banyak ion yang ada dalam larutan, semakin besar arus yang dapat dihantarkan. Dalam etanol murni, karena minimnya ion, pergerakan muatan sangat terbatas, sehingga konduktivitasnya rendah. Ilustrasi ini dapat divisualisasikan sebagai titik-titik kecil (ion) yang bergerak secara acak dalam fluida etanol, dan ketika medan listrik diberikan, mereka bergerak secara terarah, menghasilkan arus listrik.
Perbandingan Etanol dengan Elektrolit Lain
Etanol, meskipun sering digunakan sebagai pelarut dan bahan bakar, berbeda signifikan dengan elektrolit dalam kemampuannya menghantarkan arus listrik. Perbedaan ini berakar pada sifat kimiawi masing-masing zat, khususnya terkait derajat ionisasinya. Memahami perbandingan etanol dengan elektrolit lain, baik kuat maupun lemah, penting untuk mengaplikasikannya dengan tepat di berbagai bidang, mulai dari industri kimia hingga teknologi energi terbarukan.
Perbedaan Etanol dan Asam Klorida (HCl)
Asam klorida (HCl) merupakan elektrolit kuat, sementara etanol merupakan elektrolit lemah. HCl dalam larutan air terionisasi hampir sempurna menjadi ion H+ dan Cl–, sehingga menghasilkan larutan yang sangat konduktif. Sebaliknya, etanol hanya terionisasi sebagian kecil dalam air, menghasilkan sedikit ion dan konduktivitas yang rendah. Perbedaan ini disebabkan oleh kekuatan ikatan kimia dan kecenderungan untuk melepaskan ion. HCl memiliki ikatan kovalen polar yang mudah terputus dalam air, sementara ikatan dalam etanol lebih kuat dan kurang cenderung terdisosiasi menjadi ion.
Etanol, meskipun sering diasosiasikan dengan minuman beralkohol, secara kimiawi termasuk elektrolit lemah. Kemampuannya menghantarkan listrik, walau terbatas, menarik untuk dikaji. Analogi sederhana: seperti halnya menjaga keseimbangan tubuh, senam harus dilakukan secara teratur untuk kesehatan optimal, efektivitas etanol sebagai elektrolit juga dipengaruhi oleh konsentrasi dan kondisi lingkungan. Kembali ke etanol, pemahaman sifat elektrolitiknya penting dalam berbagai aplikasi, mulai dari industri hingga farmasi.
Derajat Ionisasi Etanol dan Elektrolit Kuat
Derajat ionisasi menunjukkan persentase molekul yang terionisasi dalam larutan. Elektrolit kuat, seperti HCl, memiliki derajat ionisasi mendekati 100%, artinya hampir semua molekul terionisasi. Etanol, sebagai elektrolit lemah, memiliki derajat ionisasi yang sangat rendah, jauh di bawah 1%. Hal ini secara langsung memengaruhi kemampuannya untuk menghantarkan arus listrik. Semakin tinggi derajat ionisasi, semakin banyak ion yang tersedia untuk membawa muatan listrik, dan semakin tinggi pula konduktivitasnya.
Tabel Perbandingan Etanol dan Elektrolit Lain
Berikut tabel perbandingan etanol dengan beberapa elektrolit lain, yang menunjukkan perbedaan sifat elektrolitnya:
| Nama Senyawa | Rumus Kimia | Jenis Elektrolit | Derajat Ionisasi (Perkiraan) |
|---|---|---|---|
| Etanol | C2H5OH | Elektrolit Lemah | <1% |
| Asam Klorida | HCl | Elektrolit Kuat | ≈100% |
| Asam Asetat | CH3COOH | Elektrolit Lemah | <5% |
| Natrium Klorida | NaCl | Elektrolit Kuat | ≈100% |
Implikasi Perbedaan Konduktivitas
Perbedaan konduktivitas antara etanol dan elektrolit lain memiliki implikasi signifikan dalam berbagai aplikasi. Elektrolit kuat digunakan dalam baterai, sel elektrokimia, dan berbagai proses elektrolitik karena kemampuannya menghantarkan arus listrik dengan efisien. Sebaliknya, etanol, dengan konduktivitasnya yang rendah, lebih cocok digunakan sebagai pelarut, bahan bakar, atau dalam aplikasi yang tidak memerlukan hantaran listrik yang signifikan. Contohnya, dalam industri makanan dan minuman, etanol digunakan sebagai pelarut dan pengawet, bukan sebagai penghantar listrik.
Etanol, meskipun sering diasosiasikan dengan minuman, secara kimiawi termasuk elektrolit lemah. Kemampuannya menghantarkan arus listrik, meski terbatas, berkaitan erat dengan disosiasi ionnya dalam larutan. Memahami perilaku ini penting, sebab terkait dengan konsep kesetimbangan kimia. Proses ini, seperti yang dijelaskan di langkah keseimbangan disebut juga prinsip Le Chatelier, mempengaruhi seberapa banyak ion etanol yang terionisasi dan, akibatnya, kemampuannya menghantarkan arus.
Oleh karena itu, pemahaman mendalam tentang kesetimbangan sangat krusial dalam menganalisis sifat konduktivitas etanol sebagai elektrolit.
Ilustrasi Perilaku Etanol dan Elektrolit Kuat dalam Larutan
Bayangkan dua wadah berisi air. Pada wadah pertama, kita menambahkan HCl. Ion H+ dan Cl– akan tersebar merata dalam larutan, membentuk suatu “lautan” ion yang mampu menghantarkan arus listrik dengan mudah. Jika kita masukkan elektroda dan menghubungkannya ke sumber arus, arus akan mengalir dengan lancar. Pada wadah kedua, kita menambahkan etanol. Hanya sedikit molekul etanol yang terionisasi, sehingga jumlah ion yang ada sangat sedikit. Jika kita lakukan hal yang sama, arus listrik yang mengalir akan sangat lemah, bahkan mungkin tidak terdeteksi.
Etanol, sebagai elektrolit, mampu menghantarkan arus listrik dalam larutannya. Ini berbeda dengan mekanisme pendengaran; rusaknya gendang telinga, seperti dijelaskan dalam artikel mengapa orang yang gendang telinganya rusak sulit untuk mendengarkan bunyi , mengganggu transmisi getaran suara ke otak. Analogi ini menunjukkan kompleksitas sistem biologis dibandingkan sifat fisika sederhana etanol sebagai elektrolit, yang memiliki konduksi ionik yang terukur dan mudah dipahami.
Sifat konduktif etanol, sebagai elektrolit, berbeda jauh dengan mekanisme pendengaran yang melibatkan getaran mekanis dan transduksi sinyal saraf.
Penerapan Etanol dalam Konteks Elektrolit
Etanol, meskipun bukan elektrolit kuat seperti asam atau basa, memiliki peran yang tak terduga dalam sistem elektrokimia. Sifatnya yang polar dan kemampuannya melarutkan berbagai senyawa membuatnya menjadi pelarut penting dalam berbagai aplikasi, termasuk beberapa yang melibatkan konduktivitas listrik. Artikel ini akan menjabarkan beberapa penerapan etanol dalam konteks elektrolit, mengulas bagaimana sifat-sifatnya memengaruhi kinerja sistem, serta menggarisbawahi pentingnya pemahaman mendalam tentang perilakunya dalam teknologi modern.
Contoh Penerapan Etanol dalam Sistem dengan Konduktivitas Listrik
Salah satu contoh penerapan etanol dalam sistem yang melibatkan konduktivitas listrik, meskipun lemah, adalah sebagai aditif dalam sel bahan bakar. Etanol, dalam konsentrasi tertentu, dapat meningkatkan konduktivitas larutan elektrolit dalam sel bahan bakar, meskipun peningkatannya tidak sedrastis elektrolit kuat. Hal ini karena etanol mampu melarutkan dan menstabilkan ion-ion dalam larutan, sehingga meningkatkan mobilitas ion dan pada akhirnya, konduktivitas listrik. Perlu dicatat bahwa penggunaan etanol dalam konteks ini masih dalam tahap pengembangan dan penelitian intensif untuk mengoptimalkan performanya.
Pengaruh Sifat Etanol terhadap Penerapannya
Sifat polar etanol, yang memungkinkan terjadinya interaksi dipol-dipol dengan ion-ion dalam larutan, menjadi kunci keberhasilan penerapannya. Kemampuannya melarutkan senyawa organik dan anorganik tertentu juga berperan penting. Namun, konduktivitas listrik etanol murni sangat rendah karena ia tidak terdisosiasi menjadi ion-ion. Oleh karena itu, etanol lebih berperan sebagai pelarut yang meningkatkan mobilitas ion-ion elektrolit lain yang ditambahkan ke dalam sistem, bukan sebagai konduktor utama listrik.
Pemanfaatan Sifat Etanol dalam Teknologi Larutan Elektrolit
Sifat-sifat etanol, terutama kepolarannya dan kemampuannya sebagai pelarut, dimanfaatkan dalam berbagai teknologi yang berkaitan dengan larutan elektrolit. Sebagai contoh, etanol digunakan sebagai pelarut dalam pembuatan elektroda tertentu, membantu proses pelapisan dan meningkatkan kualitas permukaan elektroda. Selain itu, etanol juga dapat berperan dalam proses sintesis senyawa elektroaktif yang digunakan dalam baterai dan superkapasitor. Penelitian terus berlanjut untuk mengeksplorasi potensi etanol lebih lanjut dalam pengembangan teknologi penyimpanan energi yang lebih efisien dan ramah lingkungan.
Peran Etanol sebagai Pelarut dalam Sistem Elektrokimia
Dalam sistem elektrokimia, etanol seringkali bertindak sebagai pelarut yang ideal karena kemampuannya melarutkan berbagai senyawa tanpa mengganggu reaksi elektrokimia utama. Sebagai contoh, etanol digunakan sebagai pelarut dalam studi elektrokimia senyawa organik, karena kemampuannya melarutkan senyawa-senyawa tersebut tanpa mengganggu reaksi redoks yang terjadi. Penggunaan etanol juga dapat membantu mengontrol viskositas larutan elektrolit, yang berdampak pada mobilitas ion dan efisiensi sistem elektrokimia.
Penting untuk memahami sifat-sifat etanol, khususnya kepolarannya dan kemampuannya sebagai pelarut, untuk mengoptimalkan kinerja sistem elektrokimia dan membuka peluang pengembangan teknologi baru di bidang energi terbarukan dan industri kimia. Pemahaman yang komprehensif akan membuka jalan bagi inovasi dan efisiensi yang lebih tinggi.
Kesimpulan: Etanol Termasuk Elektrolit
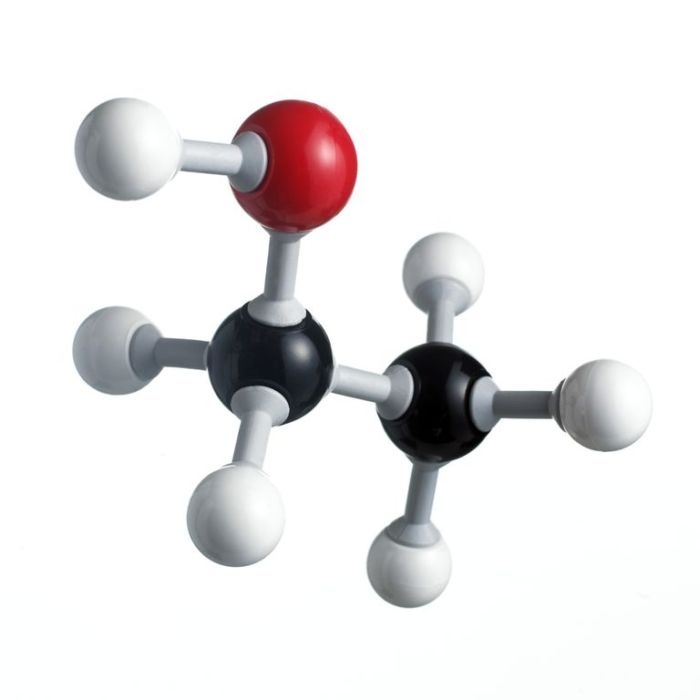
Kesimpulannya, walaupun etanol termasuk elektrolit, kemampuannya menghantarkan arus listrik sangat lemah dibandingkan elektrolit kuat. Sifat ini dipengaruhi oleh derajat ionisasinya yang rendah dan kemampuannya membentuk ikatan hidrogen yang terbatas. Pemahaman yang komprehensif tentang sifat kimia etanol, khususnya polaritas dan kemampuan membentuk ikatan hidrogen, sangat penting dalam berbagai aplikasi, termasuk dalam sistem elektrokimia. Meskipun perannya sebagai elektrolit terbatas, etanol tetap memainkan peran penting sebagai pelarut dalam berbagai proses industri dan penelitian.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya