Jelaskan mengapa larutan elektrolit dapat menghantarkan arus listrik? Pertanyaan ini mengantar kita pada dunia mikroskopis di mana muatan listrik bergerak. Bayangkan miliaran partikel bermuatan, ion-ion, berenang bebas dalam pelarut. Gerakan inilah yang memungkinkan arus listrik mengalir. Kemampuan larutan elektrolit menghantarkan listrik bukan hanya fenomena fisika sederhana, melainkan kunci pemahaman berbagai proses kimia dan teknologi, dari baterai hingga sistem saraf manusia. Memahami bagaimana ion-ion ini bergerak dan berinteraksi membuka jendela ke dunia elektrokimia yang kompleks dan menarik. Mari kita selami lebih dalam mekanisme di balik kemampuan unik ini.
Larutan elektrolit, berbeda dengan larutan non-elektrolit, mengandung partikel bermuatan yang disebut ion. Ion-ion ini, baik kation (bermuatan positif) maupun anion (bermuatan negatif), terbentuk ketika senyawa elektrolit terlarut dalam pelarut, biasanya air. Keberadaan ion-ion inilah yang memungkinkan larutan elektrolit menghantarkan arus listrik. Ketika medan listrik diterapkan, ion-ion ini bergerak menuju elektroda dengan muatan berlawanan, menghasilkan aliran arus listrik. Kekuatan daya hantar dipengaruhi oleh faktor-faktor seperti konsentrasi ion, suhu, dan jenis pelarut. Pemahaman mendalam tentang proses ini penting dalam berbagai aplikasi, dari industri hingga kehidupan sehari-hari.
Larutan Elektrolit dan Daya Hantar Listrik
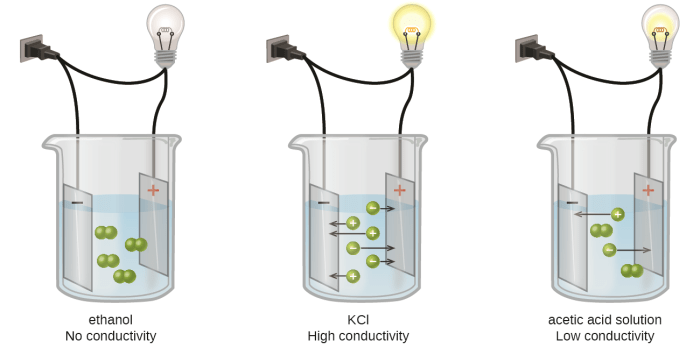
Kemampuan suatu larutan untuk menghantarkan arus listrik merupakan fenomena menarik yang mendasari banyak teknologi modern, dari baterai hingga sistem elektroplating. Memahami sifat larutan elektrolit kunci untuk mengungkap mekanisme di balik fenomena ini. Artikel ini akan mengupas tuntas tentang larutan elektrolit, mulai dari definisi hingga faktor-faktor yang memengaruhi daya hantar listriknya. Kita akan menelusuri perbedaan mendasar antara elektrolit kuat dan lemah, serta bagaimana perbedaan ini tercermin dalam perilaku partikel-partikel penyusunnya.
Kemampuan larutan elektrolit menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ion-ion ini, layaknya arus informasi yang terhubung, memungkinkan aliran muatan listrik. Analogi sederhana, seperti halnya mengapa manusia harus bekerja sama untuk mencapai tujuan bersama, ion-ion dalam larutan elektrolit berkolaborasi menghasilkan konduktivitas. Sama seperti kerja sama yang efektif menghasilkan hasil yang optimal, pergerakan ion-ion yang terkoordinasi ini memungkinkan arus listrik mengalir dengan lancar.
Jadi, efisiensi hantaran listrik dalam larutan elektrolit bergantung pada mobilitas dan jumlah ion yang tersedia.
Definisi Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena mengandung ion-ion yang bergerak bebas. Keberadaan ion-ion ini merupakan kunci utama kemampuan larutan untuk menghantarkan arus listrik. Proses penghantaran arus listrik ini terjadi melalui pergerakan ion-ion bermuatan positif (kation) dan ion-ion bermuatan negatif (anion) di dalam larutan ketika dialiri tegangan listrik. Kemampuan menghantarkan listrik ini bergantung pada jumlah ion yang terlarut dan mobilitas ion tersebut dalam larutan.
Contoh Larutan Elektrolit Kuat dan Lemah
Elektrolit diklasifikasikan menjadi elektrolit kuat dan elektrolit lemah berdasarkan seberapa banyak zat terlarut terionisasi dalam larutan. Elektrolit kuat terionisasi sempurna dalam air, sementara elektrolit lemah hanya terionisasi sebagian. Berikut beberapa contohnya:
- Elektrolit Kuat: Natrium klorida (NaCl)
NaCl(aq) → Na+(aq) + Cl–(aq)
Asam klorida (HCl)
HCl(aq) → H+(aq) + Cl–(aq)
- Elektrolit Lemah: Asam asetat (CH3COOH)
CH3COOH(aq) ⇌ CH3COO–(aq) + H+(aq)
Amonia (NH3)
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH–(aq)
Perbandingan Sifat Larutan Elektrolit Kuat dan Lemah
Perbedaan mendasar antara elektrolit kuat dan lemah terletak pada seberapa banyak zat terlarut yang terionisasi dan kemampuannya menghantarkan arus listrik. Berikut tabel perbandingannya:
| Sifat | Elektrolit Kuat | Elektrolit Lemah |
|---|---|---|
| Derajat Ionisasi (α) | ≈ 1 (hampir sempurna) | < 1 (sebagian kecil) |
| Daya Hantar Listrik | Sangat tinggi | Rendah |
Ilustrasi Perbedaan Larutan Elektrolit dan Non-Elektrolit
Bayangkan dua gelas berisi air. Gelas pertama berisi larutan elektrolit, misalnya NaCl yang terlarut. Di dalam gelas ini, ion Na+ dan Cl– bergerak bebas dan tersebar merata. Jika kita tempatkan elektroda bermuatan di dalam larutan, ion-ion ini akan bergerak menuju elektroda dengan muatan berlawanan, sehingga arus listrik dapat mengalir. Sebaliknya, gelas kedua berisi larutan non-elektrolit, seperti gula (sukrosa) yang terlarut. Molekul gula tetap utuh dan tidak terionisasi. Tidak ada ion bermuatan yang bebas bergerak, sehingga arus listrik tidak dapat mengalir. Perbedaan ini menunjukkan bagaimana keberadaan ion bebas dalam larutan menentukan kemampuannya menghantarkan arus listrik.
Faktor yang Memengaruhi Daya Hantar Listrik Larutan Elektrolit
Beberapa faktor berpengaruh terhadap daya hantar listrik suatu larutan elektrolit. Faktor-faktor tersebut antara lain konsentrasi larutan, jenis elektrolit (kuat atau lemah), suhu larutan, dan jenis pelarut yang digunakan. Semakin tinggi konsentrasi ion dalam larutan, semakin tinggi pula daya hantar listriknya. Elektrolit kuat memiliki daya hantar yang lebih tinggi daripada elektrolit lemah pada konsentrasi yang sama. Suhu yang lebih tinggi meningkatkan mobilitas ion, sehingga meningkatkan daya hantar listrik. Terakhir, sifat pelarut juga berpengaruh, karena kemampuan pelarut untuk melarutkan dan mengionisasi zat terlarut akan memengaruhi jumlah ion yang tersedia untuk menghantarkan arus listrik.
Kemampuan larutan elektrolit menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ion-ion ini, hasil disosiasi senyawa dalam pelarut, membawa muatan listrik. Sebagai contoh, larutan HCl adalah larutan elektrolit karena HCl dalam air terdisosiasi menjadi ion H+ dan Cl- , memungkinkan aliran muatan dan konduksi listrik. Dengan kata lain, pergerakan ion-ion bermuatan inilah yang menjadi kunci kemampuan larutan elektrolit untuk menghantarkan arus listrik.
Semakin banyak ion yang terdisosiasi, semakin baik daya hantar listriknya.
Proses Ionisasi dalam Larutan Elektrolit
Kemampuan larutan untuk menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak di dalamnya. Proses pembentukan ion-ion ini, yang disebut ionisasi, merupakan kunci pemahaman konduktivitas listrik larutan elektrolit. Baik senyawa ionik maupun senyawa kovalen polar dapat mengalami ionisasi dalam pelarut seperti air, menghasilkan partikel bermuatan yang memungkinkan aliran listrik. Penjelasan detail proses ini akan mengungkap mekanisme di balik fenomena tersebut.
Ionisasi dalam larutan elektrolit melibatkan pemisahan senyawa menjadi ion-ion penyusunnya. Proses ini berbeda tergantung jenis senyawa yang dilarutkan, apakah senyawa ionik atau kovalen polar. Perbedaan ini berdampak pada kekuatan elektrolit yang dihasilkan, memengaruhi seberapa baik larutan tersebut menghantarkan arus listrik.
Kemampuan larutan elektrolit menghantarkan listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ion-ion ini, hasil disosiasi senyawa elektrolit dalam pelarut, membawa muatan listrik. Analogi sederhana, keberhasilan hidup, seperti arus listrik yang mengalir deras, juga memerlukan pengelolaan yang baik. Bagaimana seorang mukmin harus bersikap ketika meraih kesuksesan? Pertanyaan ini penting, karena sebagaimana kita pelajari dari bagaimana seorang mukmin harus bersikap ketika meraih kesuksesan , kesuksesan tanpa landasan spiritual bisa bagai arus listrik liar, merusak bukan membangun.
Kembali pada elektrolit, pergerakan ion-ion inilah yang memungkinkan aliran muatan listrik, layaknya pengelolaan kesuksesan yang bijak menghasilkan dampak positif berkelanjutan.
Disosiasi Senyawa Ionik dalam Air
Senyawa ionik, seperti natrium klorida (NaCl), terdiri dari kation (ion bermuatan positif) dan anion (ion bermuatan negatif) yang terikat melalui gaya elektrostatik yang kuat dalam kisi kristal. Ketika senyawa ionik dilarutkan dalam air, molekul air polar, dengan ujung positif (hidrogen) dan ujung negatif (oksigen), mengelilingi ion-ion dalam kisi kristal. Ujung-ujung polar air menarik ion-ion dengan muatan berlawanan, melemahkan ikatan elektrostatik dalam kisi kristal. Proses ini disebut solvasi, dan dalam kasus air, disebut hidrasi. Interaksi yang kuat antara ion dan molekul air mengatasi gaya tarik-menarik antar ion dalam kisi kristal, sehingga ion-ion terpisah dan bergerak bebas dalam larutan. Proses ini menghasilkan larutan yang dapat menghantarkan arus listrik. Sebagai gambaran, bayangkan bagaimana sebutir garam dapur yang awalnya berupa kristal padat, kemudian larut sempurna dalam air, melepaskan ion Na+ dan Cl– yang dapat bergerak bebas.
Ionisasi Senyawa Kovalen Polar dalam Air
Senyawa kovalen polar, seperti asam klorida (HCl), memiliki ikatan kovalen di mana elektron tidak dibagi secara merata antara atom-atom penyusunnya, menghasilkan molekul dengan kutub positif dan negatif. Ketika senyawa kovalen polar dilarutkan dalam air, molekul air polar berinteraksi dengan molekul senyawa kovalen polar. Interaksi ini dapat menyebabkan pemutusan ikatan kovalen dan pembentukan ion. Dalam kasus HCl, molekul air menarik atom hidrogen yang bermuatan positif sebagian, memisahkannya dari atom klorin dan membentuk ion H+ (proton) dan ion Cl–. Proses ini menghasilkan ion-ion yang dapat bergerak bebas dalam larutan, memungkinkan konduktivitas listrik. Perbedaannya dengan senyawa ionik terletak pada mekanisme awal, di mana senyawa kovalen polar perlu mengalami pemutusan ikatan kovalen terlebih dahulu, berbeda dengan senyawa ionik yang hanya memerlukan pemisahan ion yang sudah ada.
Diagram Alir Ionisasi Senyawa Elektrolit dalam Air
Berikut gambaran diagram alir proses ionisasi senyawa elektrolit dalam air:
- Senyawa elektrolit (ionik atau kovalen polar) ditambahkan ke dalam air.
- Molekul air mengelilingi partikel senyawa elektrolit (hidrasi).
- Gaya tarik-menarik antara molekul air dan ion/molekul senyawa elektrolit melemahkan ikatan antar ion (ionik) atau ikatan kovalen (kovalen polar).
- Ion-ion atau molekul terionisasi terpisah dan bergerak bebas dalam larutan.
- Larutan menjadi konduktor listrik karena adanya ion-ion bermuatan yang mobile.
Perbandingan Ionisasi Elektrolit Kuat dan Lemah
Elektrolit kuat terionisasi sepenuhnya dalam air, menghasilkan konsentrasi ion yang tinggi dan konduktivitas listrik yang besar. Contohnya adalah NaCl dan HCl. Sebaliknya, elektrolit lemah hanya terionisasi sebagian dalam air, menghasilkan konsentrasi ion yang rendah dan konduktivitas listrik yang kecil. Contohnya adalah asam asetat (CH3COOH) dan amonia (NH3). Perbedaan ini disebabkan oleh perbedaan kekuatan ikatan dan kecenderungan senyawa untuk terionisasi. Elektrolit kuat memiliki ikatan yang lebih lemah atau lebih mudah terputus dalam air dibandingkan dengan elektrolit lemah. Sebagai ilustrasi, bayangkan garam dapur yang larut sempurna dibandingkan dengan cuka yang hanya terionisasi sebagian. Ini menjelaskan perbedaan konduktivitas listrik antara larutan elektrolit kuat dan lemah.
Hubungan Ion dan Daya Hantar Listrik: Jelaskan Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik
Larutan elektrolit, berbeda dengan larutan non-elektrolit, mampu menghantarkan arus listrik. Kemampuan ini bergantung pada keberadaan ion-ion bermuatan yang bergerak bebas dalam larutan. Fenomena ini mendasari berbagai aplikasi teknologi, dari baterai hingga proses elektroplating. Pemahaman mendalam tentang bagaimana ion-ion ini berperan krusial untuk mengaplikasikan prinsip-prinsip kelistrikan dalam berbagai bidang.
Peran Ion dalam Menghantarkan Arus Listrik
Ion-ion dalam larutan elektrolit, baik kation (bermuatan positif) maupun anion (bermuatan negatif), merupakan kunci kemampuan larutan untuk menghantarkan arus listrik. Keberadaan muatan-muatan ini memungkinkan perpindahan muatan listrik ketika medan listrik diterapkan. Bayangkan lautan partikel bermuatan yang bergerak secara terarah, menciptakan aliran arus. Ini berbeda dengan larutan non-elektrolit yang terdiri dari molekul netral yang tidak dapat mendukung perpindahan muatan. Kebebasan bergerak ion ini dipengaruhi oleh beberapa faktor, termasuk konsentrasi ion, suhu, dan jenis pelarut.
Faktor-faktor yang Mempengaruhi Daya Hantar Listrik
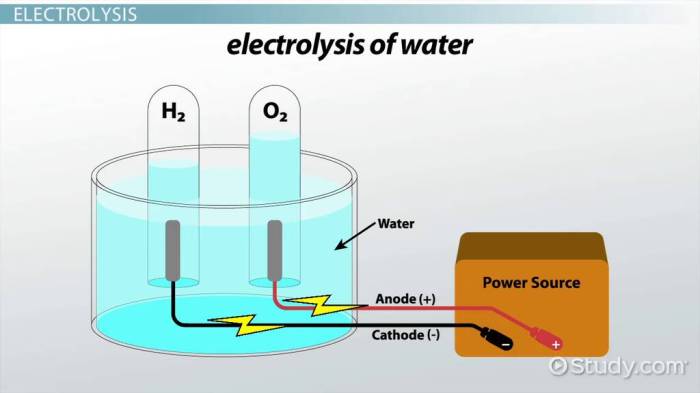
Kemampuan larutan elektrolit untuk menghantarkan arus listrik bukanlah hal yang konstan. Berbagai faktor internal dan eksternal berperan signifikan dalam menentukan seberapa baik larutan tersebut dapat mengalirkan listrik. Memahami faktor-faktor ini krusial, baik dalam konteks aplikasi industri—misalnya, dalam desain baterai yang efisien—maupun dalam pemahaman mendasar prinsip-prinsip kimia. Berikut ini uraian rinci mengenai faktor-faktor kunci yang memengaruhi daya hantar listrik larutan elektrolit.
Pengaruh Konsentrasi Elektrolit
Konsentrasi elektrolit secara langsung berbanding lurus dengan daya hantar listrik. Semakin tinggi konsentrasi ion dalam larutan, semakin banyak ion yang tersedia untuk membawa muatan listrik, sehingga daya hantarnya meningkat. Bayangkan sebuah jalan raya: semakin banyak kendaraan (ion) yang melintas, semakin tinggi “arus lalu lintas” (arus listrik). Namun, peningkatan konsentrasi ini tidaklah linier selamanya. Pada konsentrasi sangat tinggi, interaksi antar ion dapat mengurangi mobilitasnya, sehingga daya hantarnya cenderung mencapai plateau.
Eksperimen sederhana untuk menyelidiki hal ini dapat dilakukan dengan menyiapkan beberapa larutan elektrolit dengan konsentrasi berbeda (misalnya, NaCl 0,1 M, 0,5 M, dan 1 M). Ukur daya hantar listrik masing-masing larutan menggunakan konduktometer. Hasil pengukuran dapat digambarkan dalam grafik untuk menunjukkan hubungan antara konsentrasi dan daya hantar.
Grafik yang dihasilkan akan menunjukkan kurva yang awalnya naik dengan tajam, kemudian melandai pada konsentrasi tinggi. Poin jenuh ini menunjukkan bahwa meskipun konsentrasi ion meningkat, mobilitas ion berkurang karena interaksi antar ion yang semakin kuat.
Pengaruh Suhu
Suhu juga memiliki pengaruh yang signifikan terhadap daya hantar listrik. Peningkatan suhu umumnya meningkatkan daya hantar. Energi kinetik ion meningkat pada suhu yang lebih tinggi, sehingga mobilitas ion juga meningkat, memungkinkan mereka untuk bergerak lebih cepat dan membawa muatan listrik dengan lebih efisien. Analogi yang tepat adalah peningkatan kecepatan kendaraan pada jalan raya yang lebih panas—kendaraan dapat bergerak lebih cepat dan efisien. Namun, perlu diingat bahwa efek ini juga dipengaruhi oleh jenis elektrolit dan pelarut yang digunakan.
Pengaruh Jenis Pelarut, Jelaskan mengapa larutan elektrolit dapat menghantarkan arus listrik
Sifat pelarut berperan penting dalam menentukan daya hantar listrik. Pelarut polar seperti air mampu melarutkan elektrolit dan memisahkan ion-ionnya, sehingga meningkatkan daya hantar. Sebaliknya, pelarut nonpolar tidak dapat melarutkan elektrolit dengan baik, sehingga daya hantarnya rendah. Konstanta dielektrik pelarut juga memengaruhi daya hantar. Pelarut dengan konstanta dielektrik tinggi mampu mengurangi gaya tarik menarik antar ion, sehingga meningkatkan mobilitas ion dan daya hantar listrik.
Pengaruh Jenis Elektrolit
Sifat elektrolit itu sendiri, khususnya valensi ion dan ukuran ion, juga memengaruhi daya hantar. Elektrolit yang terurai menjadi ion dengan muatan lebih tinggi (valensi lebih besar) akan menghasilkan daya hantar yang lebih tinggi daripada elektrolit dengan valensi ion lebih rendah pada konsentrasi yang sama. Ukuran ion juga berperan; ion yang lebih kecil dan lebih mobile akan berkontribusi pada daya hantar yang lebih tinggi. Sebagai contoh, larutan NaCl akan memiliki daya hantar berbeda dengan larutan MgCl2 pada konsentrasi yang sama karena perbedaan valensi ion Mg2+ dan Na+.
Penutupan
Kesimpulannya, kemampuan larutan elektrolit menghantarkan arus listrik berakar pada keberadaan dan mobilitas ion-ion di dalamnya. Proses ionisasi, baik melalui disosiasi senyawa ionik atau ionisasi senyawa kovalen polar, menghasilkan partikel bermuatan yang mampu bergerak di bawah pengaruh medan listrik. Faktor-faktor seperti konsentrasi elektrolit, suhu, dan jenis pelarut secara signifikan memengaruhi daya hantar listrik. Mempelajari fenomena ini bukan hanya sekadar memahami konsep dasar fisika dan kimia, melainkan juga membuka pintu menuju inovasi teknologi dan pemahaman yang lebih dalam tentang berbagai proses alamiah yang bergantung pada hantaran listrik.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya