Jelaskan mengapa larutan elektrolit dapat menghantarkan arus listrik? Pertanyaan ini mengungkap rahasia di balik kemampuan beberapa larutan untuk menyalurkan energi listrik. Fenomena ini, yang mendasari banyak teknologi modern, berakar pada sifat unik partikel-partikel penyusun larutan tersebut. Lebih dari sekadar reaksi kimia sederhana, proses ini melibatkan interaksi rumit antara ion-ion bermuatan dan medan listrik, menghasilkan aliran elektron yang kita kenal sebagai arus listrik. Memahami dasar-dasar ini membuka pintu untuk aplikasi luas, mulai dari baterai hingga sistem kelistrikan canggih.
Larutan elektrolit, berbeda dengan larutan non-elektrolit, mengandung ion-ion bermuatan yang bebas bergerak. Kebebasan gerak inilah yang menjadi kunci kemampuannya menghantarkan arus listrik. Ketika suatu tegangan listrik diterapkan, ion-ion positif (kation) bergerak menuju kutub negatif, sementara ion-ion negatif (anion) bergerak menuju kutub positif. Pergerakan berlawanan arah ini menciptakan aliran muatan listrik, membentuk arus listrik yang dapat diukur dan dimanfaatkan. Kekuatan arus listrik yang dihasilkan bergantung pada beberapa faktor, termasuk konsentrasi ion, jenis elektrolit, dan suhu larutan.
Larutan Elektrolit dan Daya Hantar Listrik
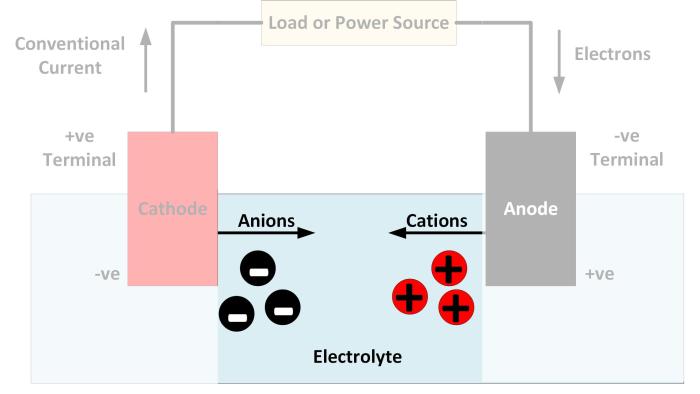
Kemampuan suatu larutan untuk menghantarkan arus listrik merupakan fenomena dasar dalam kimia dan fisika. Memahami prinsip kerja larutan elektrolit krusial dalam berbagai aplikasi, mulai dari baterai hingga proses elektrokimia di dalam tubuh kita. Artikel ini akan mengupas tuntas definisi larutan elektrolit, memberikan contoh nyata, serta membedah perbedaan antara elektrolit kuat dan lemah.
Definisi Larutan Elektrolit
Larutan elektrolit adalah larutan yang mengandung ion-ion bermuatan listrik yang bebas bergerak, sehingga mampu menghantarkan arus listrik. Keberadaan ion-ion ini berasal dari proses disosiasi atau ionisasi zat terlarut dalam pelarut, umumnya air. Proses ini menghasilkan kation (ion bermuatan positif) dan anion (ion bermuatan negatif) yang dapat membawa muatan listrik melalui larutan ketika dialiri tegangan.
Contoh Larutan Elektrolit dalam Kehidupan Sehari-hari
Larutan elektrolit bukan sekadar konsep abstrak di laboratorium. Kita berinteraksi dengannya setiap hari. Air laut, misalnya, kaya akan garam terlarut (NaCl) yang terionisasi menjadi Na+ dan Cl–, membuatnya menjadi konduktor listrik yang baik. Begitu pula minuman isotonik yang kita konsumsi setelah berolahraga, mengandung elektrolit seperti natrium, kalium, dan magnesium untuk mengganti mineral yang hilang. Bahkan cairan tubuh kita sendiri merupakan larutan elektrolit kompleks yang berperan vital dalam berbagai fungsi fisiologis.
Perbedaan Elektrolit Kuat dan Lemah
Elektrolit kuat dan lemah memiliki perbedaan signifikan dalam kemampuannya menghantarkan listrik dan tingkat ionisasinya. Perbedaan ini bergantung pada seberapa banyak zat terlarut terurai menjadi ion dalam larutan. Elektrolit kuat terionisasi hampir sempurna, sementara elektrolit lemah hanya terionisasi sebagian kecil.
Larutan elektrolit menghantarkan listrik karena adanya ion-ion bermuatan yang bergerak bebas, berbeda dengan lelehan senyawa kovalen polar yang tak mampu melakukan hal serupa. Hal ini disebabkan karena, seperti dijelaskan dalam artikel lelehan senyawa kovalen polar tidak dapat menghantarkan listrik karena kekurangan partikel bermuatan. Intinya, mobilitas ion dalam larutan elektrolit memungkinkan aliran muatan listrik, menciptakan daya hantar.
Jadi, keberadaan ion bebas merupakan kunci kemampuan suatu larutan untuk menghantarkan arus listrik.
Tabel Perbandingan Elektrolit Kuat dan Lemah
Tabel berikut merangkum perbedaan kunci antara elektrolit kuat dan lemah. Perbedaan ini terlihat jelas dalam daya hantar listrik dan derajat ionisasi.
| Nama Elektrolit | Jenis Elektrolit | Daya Hantar Listrik | Derajat Ionisasi |
|---|---|---|---|
| Asam Klorida (HCl) | Kuat | Sangat Tinggi | ≈ 100% |
| Natrium Klorida (NaCl) | Kuat | Tinggi | ≈ 100% |
| Asam Asetat (CH3COOH) | Lemah | Rendah | << 100% |
| Amonia (NH3) | Lemah | Rendah | << 100% |
Ilustrasi Tingkat Ionisasi Elektrolit Kuat dan Lemah
Bayangkan sebuah wadah berisi molekul-molekul terlarut. Pada elektrolit kuat, hampir semua molekul terurai sempurna menjadi ion-ion yang terpisah dan bergerak bebas. Ini seperti sekelompok orang yang berpisah dan bergerak sendiri-sendiri. Sebaliknya, pada elektrolit lemah, sebagian besar molekul tetap utuh, hanya sebagian kecil yang terurai menjadi ion. Ini seperti sekelompok orang yang sebagian besar masih berkelompok, hanya beberapa yang terpisah.
Perbedaan ini secara visual dapat digambarkan sebagai berikut: Elektrolit kuat ditunjukkan dengan banyak ion yang terpisah dan bergerak bebas, sedangkan elektrolit lemah menunjukkan sebagian besar molekul utuh dengan sedikit ion yang terpisah. Tingkat kepadatan ion yang lebih tinggi pada elektrolit kuat menjelaskan daya hantar listrik yang jauh lebih baik dibandingkan dengan elektrolit lemah.
Proses Ionisasi dalam Larutan Elektrolit: Jelaskan Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik
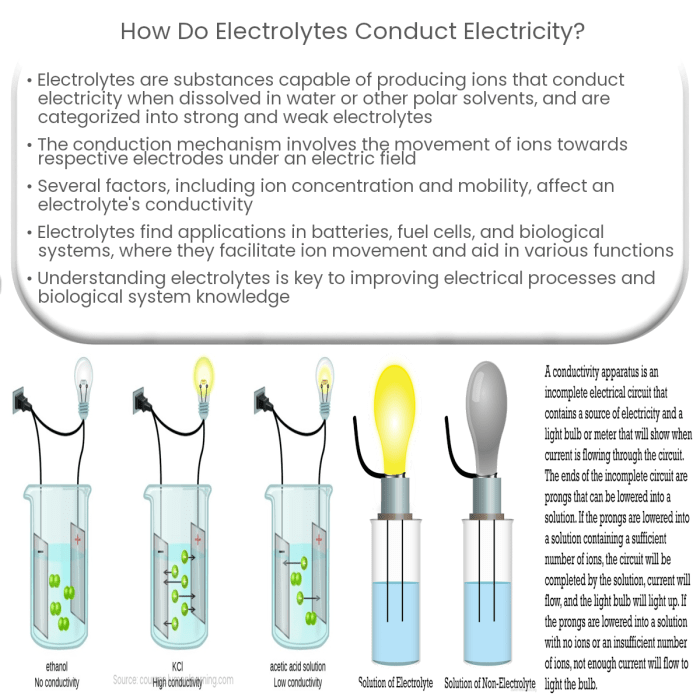
Kemampuan larutan elektrolit menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Proses pembentukan ion-ion ini, yang disebut ionisasi, merupakan kunci pemahaman fenomena konduktivitas listrik dalam larutan. Proses ini melibatkan interaksi kompleks antara molekul elektrolit dan molekul pelarut, terutama air. Berikut uraian detail mengenai mekanisme ionisasi dalam larutan elektrolit.
Ionisasi adalah proses di mana suatu senyawa elektrolit terurai menjadi ion-ion penyusunnya ketika dilarutkan dalam suatu pelarut. Proses ini menghasilkan ion-ion bermuatan positif (kation) dan ion-ion bermuatan negatif (anion) yang bebas bergerak, memungkinkan aliran muatan listrik. Air, sebagai pelarut polar yang umum, memainkan peran krusial dalam proses ini.
Kemampuan larutan elektrolit menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ion-ion ini, hasil disosiasi senyawa elektrolit dalam pelarut, membawa muatan listrik sehingga memungkinkan aliran arus. Menariknya, perilaku ini berbeda dengan sifat koligatif larutan, misalnya tekanan uap. Untuk memahami lebih lanjut tentang tekanan uap, silahkan baca artikel ini: larutan yang memiliki tekanan uap paling tinggi adalah.
Kembali ke elektrolit, konsentrasi ion dan mobilitasnya menentukan seberapa baik larutan tersebut menghantarkan arus; semakin banyak ion dan semakin mudah bergerak, semakin baik daya hantarnya.
Peran Air sebagai Pelarut
Air, dengan sifat kepolarannya yang tinggi, mampu memisahkan ion-ion dalam senyawa elektrolit. Molekul air memiliki struktur dipol, dengan atom oksigen yang bermuatan sebagian negatif (δ-) dan atom hidrogen yang bermuatan sebagian positif (δ+). Kutub negatif molekul air menarik kation dari elektrolit, sementara kutub positifnya menarik anion. Interaksi elektrostatis antara ion-ion elektrolit dan dipol air ini cukup kuat untuk mengatasi gaya tarik-menarik antar ion dalam kristal elektrolit, sehingga ion-ion tersebut terlepas dan terhidrasi (dikelilingi oleh molekul air). Proses hidrasi ini menstabilkan ion-ion dalam larutan dan mencegah mereka bergabung kembali membentuk senyawa netral. Bayangkan seperti sekelompok bola magnet yang saling menempel, kemudian dipisahkan oleh bola-bola kecil yang bermuatan berlawanan, yang secara efektif mengurangi daya tarik antar bola magnet.
Jenis Ikatan Kimia dalam Elektrolit dan Pengaruhnya terhadap Ionisasi
Jenis ikatan kimia dalam elektrolit sangat menentukan tingkat ionisasinya. Senyawa ionik, seperti natrium klorida (NaCl), memiliki ikatan ionik yang relatif mudah diputus oleh air, sehingga menghasilkan ionisasi yang hampir sempurna. Sebaliknya, senyawa kovalen polar, seperti asam asetat (CH3COOH), memiliki ikatan kovalen yang lebih kuat, sehingga hanya sebagian kecil molekul yang terionisasi dalam air. Ikatan kovalen koordinasi juga berperan dalam beberapa elektrolit, contohnya pada kompleks logam transisi. Kekuatan ikatan ini mempengaruhi seberapa mudah elektrolit tersebut terionisasi.
Diagram Alir Proses Ionisasi Senyawa Elektrolit
Berikut diagram alir sederhana proses ionisasi suatu senyawa elektrolit:
- Senyawa elektrolit (padat) dilarutkan dalam air.
- Molekul air berinteraksi dengan ion-ion dalam senyawa elektrolit melalui gaya tarik-menarik elektrostatis.
- Gaya tarik-menarik antara ion-ion dalam senyawa elektrolit melemah.
- Ion-ion terpisah dan terhidrasi oleh molekul air.
- Terbentuk larutan elektrolit yang mengandung ion-ion bermuatan bebas bergerak.
Contoh Reaksi Ionisasi Elektrolit Kuat dan Lemah, Jelaskan mengapa larutan elektrolit dapat menghantarkan arus listrik
Elektrolit kuat terionisasi sempurna dalam air, sedangkan elektrolit lemah hanya terionisasi sebagian. Perbedaan ini tercermin dalam konstanta ionisasi (Ka atau Kb).
Elektrolit Kuat: Natrium klorida (NaCl) terionisasi sempurna dalam air:
NaCl(s) → Na+(aq) + Cl–(aq)
Elektrolit Lemah: Asam asetat (CH3COOH) hanya terionisasi sebagian dalam air:
CH3COOH(aq) ⇌ CH3COO–(aq) + H+(aq)
Tanda panah tunggal pada reaksi NaCl menunjukkan ionisasi sempurna, sedangkan tanda panah bolak-balik pada reaksi CH3COOH menunjukkan kesetimbangan antara molekul yang terionisasi dan yang tidak terionisasi. Elektrolit kuat memiliki Ka atau Kb yang besar, sementara elektrolit lemah memiliki Ka atau Kb yang kecil.
Peran Ion dalam Menghantarkan Arus Listrik
Larutan elektrolit, berbeda dengan larutan non-elektrolit, mampu menghantarkan arus listrik. Kemampuan ini bergantung pada keberadaan ion-ion bermuatan yang bergerak bebas di dalam larutan. Gerakan ion-ion ini, dipengaruhi oleh berbagai faktor, menjadi kunci pemahaman bagaimana arus listrik dapat mengalir. Penjelasan detailnya akan diuraikan berikut ini.
Kemampuan larutan elektrolit menghantarkan arus listrik merupakan fenomena dasar yang mendasari banyak aplikasi teknologi, mulai dari baterai hingga proses elektroplating. Memahami mekanisme konduksi ini krusial untuk mengoptimalkan kinerja berbagai perangkat dan sistem.
Kemampuan larutan elektrolit menghantarkan listrik bergantung pada keberadaan ion-ion bermuatan yang bebas bergerak. Ion-ion ini, hasil disosiasi senyawa elektrolit dalam pelarut, membawa muatan listrik sehingga memungkinkan aliran arus. Analogi sederhana, seperti upaya pemerintah kolonial mendirikan sekolah-sekolah untuk kaum pribumi dengan tujuan yang tertera di https://www.tendikpedia.com/pemerintah-kolonial-mendirikan-sekolah-sekolah-untuk-kaum-pribumi-dengan-tujuan , menunjukkan bagaimana “arus” pengetahuan diharapkan mengalir dan menyebar. Kembali pada larutan elektrolit, pergerakan ion-ion ini, layaknya penyebaran informasi, menentukan seberapa baik larutan tersebut menghantarkan arus listrik; konsentrasi ion menjadi faktor penentu efisiensinya.
Gerakan Bebas Ion dalam Larutan Elektrolit
Ion-ion dalam larutan elektrolit, seperti ion natrium (Na+) dan klorida (Cl-) dalam larutan garam, tidaklah statis. Mereka bergerak secara acak, bertabrakan satu sama lain dan dengan molekul pelarut (misalnya air). Namun, gerakan ini menjadi terarah ketika medan listrik diterapkan. Energi kinetik ion-ion ini memungkinkan mereka untuk berpindah tempat, dan kecepatan perpindahan ini, dipengaruhi oleh beberapa faktor yang akan dibahas selanjutnya. Bayangkan seperti sekumpulan bola biliar yang bertabrakan secara acak, namun ketika kita dorong salah satu bola, gerakannya akan memengaruhi bola lainnya, menciptakan gerakan yang lebih terarah.
Mobilitas Ion dan Konduksi Listrik
Mobilitas ion didefinisikan sebagai kecepatan pergerakan ion dalam medan listrik tertentu. Ion dengan mobilitas tinggi akan berkontribusi lebih besar terhadap konduksi listrik. Semakin tinggi mobilitas ion, semakin efisien larutan tersebut menghantarkan arus listrik. Faktor-faktor seperti ukuran ion, viskositas pelarut, dan suhu berpengaruh signifikan terhadap mobilitas ini. Ion-ion kecil dan ringan cenderung memiliki mobilitas yang lebih tinggi dibandingkan ion-ion besar dan berat.
Faktor-faktor yang Mempengaruhi Mobilitas Ion
- Ukuran dan Muatan Ion: Ion yang lebih kecil dan bermuatan lebih tinggi umumnya memiliki mobilitas yang lebih besar karena gaya gesekan yang lebih rendah dan gaya tarik elektrostatik yang lebih kuat.
- Viskositas Pelarut: Pelarut dengan viskositas tinggi akan menghambat pergerakan ion, sehingga mengurangi mobilitasnya. Air, misalnya, memiliki viskositas yang relatif rendah, sehingga mendukung mobilitas ion yang tinggi.
- Suhu: Peningkatan suhu meningkatkan energi kinetik ion, sehingga meningkatkan mobilitasnya. Hal ini disebabkan karena peningkatan energi kinetik mengatasi gaya gesekan antar ion dan molekul pelarut.
- Konsentrasi Ion: Pada konsentrasi ion yang tinggi, interaksi antar ion meningkat, yang dapat mengurangi mobilitas ion secara efektif karena adanya gaya tarik-menarik antar ion dengan muatan yang berlawanan.
Hubungan Konsentrasi Ion dan Daya Hantar Listrik
Konsentrasi ion berbanding lurus dengan daya hantar listrik. Semakin tinggi konsentrasi ion dalam larutan, semakin banyak pembawa muatan yang tersedia untuk menghantarkan arus listrik, sehingga daya hantar listriknya semakin tinggi. Ini karena semakin banyak ion yang bergerak, semakin besar arus listrik yang dapat dihantarkan. Namun, pada konsentrasi sangat tinggi, interaksi antar ion dapat mengurangi mobilitas ion dan daya hantar listrik.
Pergerakan Ion dan Arus Listrik
Ketika medan listrik diterapkan pada larutan elektrolit, ion-ion bermuatan positif (kation) akan bergerak menuju kutub negatif (katoda), sementara ion-ion bermuatan negatif (anion) akan bergerak menuju kutub positif (anoda). Gerakan terarah ini merupakan arus listrik. Jumlah muatan yang diangkut per satuan waktu menentukan besarnya arus listrik yang mengalir. Proses ini mirip dengan aliran air dalam pipa, di mana ion-ion bertindak sebagai partikel air yang mengalir melalui pipa (larutan elektrolit) di bawah pengaruh gaya (medan listrik).
Faktor-faktor yang Mempengaruhi Daya Hantar Listrik Larutan Elektrolit
Kemampuan larutan elektrolit untuk menghantarkan arus listrik bukanlah hal yang konstan. Berbagai faktor berperan, menentukan seberapa efektif larutan tersebut dalam mengalirkan muatan listrik. Memahami faktor-faktor ini krusial, baik dalam konteks aplikasi industri—dari baterai hingga pelapisan logam—maupun dalam pemahaman mendasar prinsip-prinsip kimia. Mari kita telusuri lebih dalam faktor-faktor yang memengaruhi daya hantar listrik larutan elektrolit, mulai dari konsentrasi hingga suhu dan jenis elektrolit itu sendiri.
Daya hantar listrik larutan elektrolit bergantung pada beberapa faktor kunci yang saling terkait. Semakin banyak ion yang bergerak bebas dalam larutan, semakin baik daya hantarnya. Faktor-faktor ini membentuk interaksi kompleks yang menentukan efisiensi aliran muatan listrik dalam suatu larutan.
Pengaruh Konsentrasi Elektrolit
Konsentrasi elektrolit secara langsung memengaruhi jumlah ion yang tersedia untuk menghantarkan arus listrik. Semakin tinggi konsentrasi, semakin banyak ion yang terdisosiasi dalam larutan, sehingga meningkatkan jumlah pembawa muatan dan meningkatkan daya hantar. Sebaliknya, larutan encer memiliki lebih sedikit ion, sehingga daya hantarnya lebih rendah. Ini karena semakin banyak zat terlarut yang terionisasi, semakin banyak pula ion yang tersedia untuk membawa arus.
Percobaan sederhana untuk membuktikan hal ini dapat dilakukan dengan menggunakan beberapa larutan elektrolit dengan konsentrasi berbeda (misalnya, NaCl 0,1 M, 0,5 M, dan 1 M). Ukur daya hantar masing-masing larutan menggunakan alat ukur konduktivitas. Hasilnya akan menunjukkan bahwa daya hantar meningkat seiring dengan peningkatan konsentrasi.
Pengaruh Suhu terhadap Daya Hantar
Suhu juga memainkan peran penting dalam daya hantar listrik larutan elektrolit. Peningkatan suhu meningkatkan energi kinetik ion-ion dalam larutan. Hal ini menyebabkan ion-ion bergerak lebih cepat dan lebih bebas, sehingga meningkatkan frekuensi tumbukan dan meningkatkan daya hantar listrik. Namun, perlu diingat bahwa efek ini terbatas. Pada suhu yang sangat tinggi, struktur larutan bisa berubah dan bahkan menurunkan daya hantar.
Pengaruh Jenis Elektrolit
Jenis elektrolit juga berpengaruh signifikan. Elektrolit kuat, seperti asam kuat (HCl, HNO3, H2SO4), basa kuat (NaOH, KOH), dan garam-garam yang larut sempurna, terdisosiasi sepenuhnya dalam larutan, menghasilkan banyak ion dan daya hantar yang tinggi. Sebaliknya, elektrolit lemah hanya terdisosiasi sebagian, menghasilkan sedikit ion dan daya hantar yang rendah. Derajat ionisasi elektrolit menentukan jumlah ion yang tersedia untuk menghantarkan arus.
Tabel Hubungan Faktor-Faktor dengan Daya Hantar Listrik
| Faktor | Nilai Faktor | Jenis Elektrolit | Daya Hantar (µS/cm – nilai ilustrasi) |
|---|---|---|---|
| Konsentrasi | 0.1 M | NaCl | 1000 |
| Konsentrasi | 1 M | NaCl | 10000 |
| Suhu | 25°C | NaCl 1M | 10000 |
| Suhu | 50°C | NaCl 1M | 12000 |
| Jenis Elektrolit | – | NaCl | 10000 |
| Jenis Elektrolit | – | CH3COOH (asam asetat) | 500 |
Dampak Penambahan Zat Terlarut Lain
Penambahan zat terlarut lain dapat memengaruhi daya hantar dengan beberapa cara. Jika zat terlarut tersebut juga merupakan elektrolit, maka daya hantar akan meningkat. Namun, jika zat terlarut bersifat non-elektrolit (tidak terionisasi), maka daya hantar bisa sedikit menurun karena interaksi antar ion yang ada bisa terganggu. Kehadiran zat terlarut lain dapat mengubah viskositas larutan, yang juga berpengaruh pada mobilitas ion dan daya hantar. Efek ini bergantung pada sifat dan konsentrasi zat terlarut yang ditambahkan.
Ringkasan Akhir
Singkatnya, kemampuan larutan elektrolit menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan yang bergerak bebas di dalam larutan. Pergerakan ion-ion ini, yang dipengaruhi oleh faktor-faktor seperti konsentrasi, suhu, dan jenis elektrolit, menghasilkan aliran muatan listrik yang membentuk arus listrik. Pemahaman mendalam tentang proses ionisasi dan mobilitas ion dalam larutan elektrolit memiliki implikasi yang signifikan dalam berbagai bidang, dari pengembangan baterai yang lebih efisien hingga pemahaman proses biologi di dalam tubuh kita sendiri. Ini menunjukkan betapa pentingnya konsep dasar kimia ini dalam dunia modern.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya