Lelehan senyawa kovalen polar tidak dapat menghantarkan listrik karena molekulnya netral dan tidak terionisasi. Berbeda dengan senyawa ionik yang terurai menjadi ion-ion bermuatan ketika meleleh, senyawa kovalen polar tetap mempertahankan ikatan kovalennya. Ketiadaan muatan bebas bergerak ini menjadi kunci mengapa lelehan senyawa ini bertindak sebagai isolator listrik. Fenomena ini menunjukkan perbedaan mendasar dalam sifat konduktivitas listrik antara senyawa ionik dan kovalen. Pemahaman akan hal ini penting untuk berbagai aplikasi, dari pengembangan baterai hingga desain material elektronik.
Senyawa kovalen polar, meskipun memiliki kutub positif dan negatif dalam molekulnya, tidak memiliki partikel bermuatan bebas yang dapat bergerak dan membawa arus listrik. Bayangkan molekul-molekulnya seperti bola-bola kecil yang saling berikatan erat, tidak ada muatan yang bisa lepas dan mengalir. Sebaliknya, senyawa ionik seperti garam dapur, akan terurai menjadi ion Na+ dan Cl- ketika meleleh, ion-ion inilah yang kemudian menjadi pembawa arus listrik. Perbedaan mendasar ini menjelaskan mengapa garam dapur dapat menghantarkan listrik dalam keadaan cair, sementara gula (suatu senyawa kovalen polar) tidak.
Senyawa Kovalen Polar: Mengapa Air Mengalir, Tapi Lemak Mengumpul?

Perbedaan sifat fisika dan kimia antar zat seringkali menjadi kunci pemahaman mendasar dalam berbagai bidang, dari industri hingga kesehatan. Memahami karakteristik senyawa kovalen polar dan nonpolar, misalnya, sangat krusial untuk menjelaskan perilaku berbagai material dalam kehidupan sehari-hari. Mengapa air, yang merupakan senyawa kovalen polar, mudah larut dalam banyak zat, sementara lemak, yang umumnya nonpolar, cenderung tidak? Jawabannya terletak pada perbedaan struktur molekul dan interaksi antarmolekulnya.
Perbedaan Senyawa Kovalen Polar dan Nonpolar
Senyawa kovalen terbentuk melalui pemakaian bersama pasangan elektron antar atom. Namun, perbedaan elektronegativitas atom-atom penyusunnya menentukan apakah ikatan kovalen tersebut bersifat polar atau nonpolar. Jika perbedaan elektronegativitasnya besar, elektron lebih tertarik ke atom yang lebih elektronegatif, menciptakan dipol (kutub positif dan negatif) dan menghasilkan ikatan kovalen polar. Sebaliknya, jika perbedaan elektronegativitasnya kecil atau mendekati nol, elektron terbagi relatif merata, menghasilkan ikatan kovalen nonpolar. Ini mempengaruhi sifat fisik dan kimia senyawa secara signifikan.
Contoh Senyawa Kovalen Polar dan Nonpolar beserta Struktur Lewis
Air (H₂O) merupakan contoh klasik senyawa kovalen polar. Atom oksigen (O) lebih elektronegatif daripada atom hidrogen (H), sehingga elektron lebih tertarik ke atom oksigen, menciptakan dipol. Struktur Lewis-nya menunjukkan pasangan elektron bebas pada atom oksigen yang memperkuat kepolaran molekul. Sebaliknya, metana (CH₄) adalah contoh senyawa kovalen nonpolar. Perbedaan elektronegativitas antara karbon (C) dan hidrogen (H) sangat kecil, sehingga elektron terbagi hampir merata, menghasilkan molekul yang nonpolar. Struktur Lewis metana menunjukkan distribusi elektron yang simetris.
Perbandingan Sifat Fisika Senyawa Kovalen Polar dan Nonpolar
| Nama Senyawa | Jenis Ikatan | Titik Didih (°C) | Kelarutan dalam Air |
|---|---|---|---|
| Air (H₂O) | Kovalen Polar | 100 | Larut |
| Metana (CH₄) | Kovalen Nonpolar | -161.5 | Tidak Larut |
| Amonia (NH₃) | Kovalen Polar | -33.34 | Larut |
| Karbon Tetraklorida (CCl₄) | Kovalen Nonpolar | 76.72 | Tidak Larut |
Faktor-faktor yang Mempengaruhi Kepolaran Senyawa Kovalen
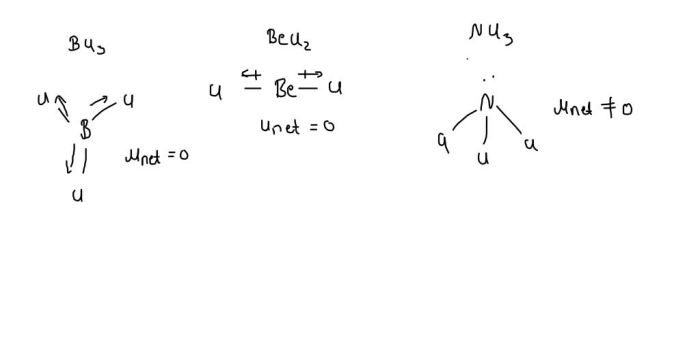
Kepolaran suatu senyawa kovalen dipengaruhi oleh beberapa faktor utama, terutama perbedaan elektronegativitas atom-atom penyusunnya dan geometri molekul. Semakin besar perbedaan elektronegativitas, semakin polar ikatannya. Geometri molekul juga berperan; molekul simetris cenderung nonpolar meskipun memiliki ikatan polar, karena momen dipolnya saling meniadakan. Sebagai contoh, karbon dioksida (CO₂) memiliki ikatan polar (C=O), tetapi molekulnya linier dan simetris, sehingga momen dipolnya saling meniadakan dan molekul secara keseluruhan bersifat nonpolar.
Ilustrasi Molekul Air (H₂O) dan Karbon Dioksida (CO₂)
Molekul air memiliki bentuk bengkok (non-linier) dengan atom oksigen di pusat dan dua atom hidrogen di sisi yang berlawanan. Karena perbedaan elektronegativitas yang signifikan antara oksigen dan hidrogen, terjadi pemisahan muatan parsial, menciptakan dipol permanen yang membuat air bersifat polar. Sebaliknya, molekul karbon dioksida memiliki bentuk linier dengan atom karbon di tengah dan dua atom oksigen di kedua sisinya. Meskipun ikatan C=O bersifat polar, karena bentuk molekul yang simetris, momen dipol ikatan saling meniadakan, sehingga molekul CO₂ secara keseluruhan bersifat nonpolar.
Konduksi Listrik
Kemampuan suatu zat untuk menghantarkan listrik merupakan sifat fisika yang sangat fundamental. Pemahaman mendalam tentang konduksi listrik, khususnya dalam larutan, crucial dalam berbagai aplikasi, mulai dari baterai hingga industri elektrokimia. Sifat ini ditentukan oleh struktur dan jenis ikatan kimia penyusun zat tersebut. Mari kita telusuri lebih dalam bagaimana mekanisme konduksi listrik bekerja dan bagaimana perbedaannya antara senyawa ionik dan kovalen polar.
Lelehan senyawa kovalen polar, berbeda dengan senyawa ionik, tak mampu menghantarkan listrik karena ikatan kovalennya yang kuat. Mereka tak membentuk ion bebas yang dapat bergerak membawa muatan listrik. Konsep ini mirip dengan prinsip matematika dasar: ingatkah Anda bahwa positif kali negatif hasilnya negatif? Analogi ini membantu memahami mengapa distribusi muatan yang relatif seimbang dalam lelehan kovalen polar ini mencegah konduksi listrik yang efektif.
Intinya, ketiadaan muatan bebas inilah yang membuat lelehan senyawa kovalen polar tidak dapat menghantarkan listrik.
Konduksi listrik dalam larutan bergantung pada keberadaan partikel bermuatan yang bebas bergerak. Dalam senyawa ionik, ion-ion bermuatan positif dan negatif terikat oleh gaya elektrostatik yang kuat. Namun, ketika senyawa ionik dilarutkan dalam air, ikatan ionik ini terputus, dan ion-ion tersebut menjadi bebas bergerak, sehingga mampu menghantarkan listrik. Sebaliknya, senyawa kovalen polar, meskipun memiliki perbedaan muatan parsial, umumnya tidak menghasilkan ion bebas dalam larutan, sehingga konduktivitas listriknya jauh lebih rendah.
Mekanisme Konduksi Listrik dalam Larutan
Listrik adalah aliran elektron atau ion. Dalam larutan, konduksi listrik terjadi melalui pergerakan ion-ion bermuatan. Senyawa yang terionisasi dalam larutan menghasilkan ion-ion yang bebas bergerak di bawah pengaruh medan listrik. Pergerakan ion-ion inilah yang memungkinkan arus listrik mengalir. Semakin banyak ion yang terdisosiasi, semakin tinggi pula konduktivitas larutan tersebut. Sebagai analogi, bayangkan lalu lintas kendaraan. Semakin banyak kendaraan yang melaju, semakin padat dan lancar aliran kendaraan, begitu pula dengan ion dalam larutan.
Perbandingan Kemampuan Menghantarkan Listrik
Senyawa ionik, seperti garam dapur (NaCl), menghantarkan listrik dengan baik dalam keadaan cair dan larutan karena adanya ion-ion Na+ dan Cl- yang bergerak bebas. Sebaliknya, senyawa kovalen polar seperti gula (sukrosa), tidak menghantarkan listrik dalam keadaan cair maupun larutan karena molekulnya tidak terionisasi. Perbedaan ini terletak pada kemampuan senyawa untuk menghasilkan ion-ion bermuatan bebas yang berperan sebagai pembawa muatan listrik.
Lelehan senyawa kovalen polar, berbeda dengan senyawa ionik, tak mampu menghantarkan listrik karena minimnya ion bebas bergerak. Analogi sederhana: ketahanan budaya daerah kita seperti ikatan kovalen itu, kuat namun butuh upaya ekstra untuk tetap lestari. Memahami mengapa kita harus melestarikan budaya daerah, seperti membaca artikel di mengapa kita harus melestarikan budaya daerah , penting untuk menjaga kekayaan bangsa.
Kembali ke inti pembahasan, ketidakmampuan lelehan senyawa kovalen polar menghantarkan listrik berasal dari struktur molekulnya yang tidak terionisasi, membatasi pergerakan muatan listrik.
Contoh Senyawa yang Dapat dan Tidak Dapat Menghantarkan Listrik
Berikut beberapa contoh senyawa yang menggambarkan perbedaan konduktivitas listrik: NaCl (garam dapur) dan HCl (asam klorida) merupakan contoh senyawa yang dapat menghantarkan listrik dalam keadaan cair dan larutan karena terionisasi sempurna. Sementara itu, gula (sukrosa) dan etanol (alkohol) merupakan contoh senyawa yang tidak dapat menghantarkan listrik karena tidak terionisasi.
Tabel Perbandingan Konduktivitas Listrik
| Nama Senyawa | Jenis Ikatan | Konduktivitas dalam Keadaan Cair | Konduktivitas dalam Larutan |
|---|---|---|---|
| Natrium Klorida (NaCl) | Ionik | Tinggi | Tinggi |
| Asam Klorida (HCl) | Kovalen Polar (tapi terionisasi kuat dalam air) | Tinggi | Tinggi |
| Sukrosa (C₁₂H₂₂O₁₁) | Kovalen Polar | Rendah | Rendah |
| Etanol (C₂H₅OH) | Kovalen Polar | Rendah | Rendah |
Kondisi yang Diperlukan Agar Suatu Senyawa Dapat Menghantarkan Listrik
Suatu senyawa dapat menghantarkan listrik jika mengandung partikel bermuatan (ion atau elektron) yang bebas bergerak. Kondisi ini dapat terpenuhi jika senyawa tersebut terionisasi, baik secara spontan (seperti dalam senyawa ionik) atau melalui proses disosiasi dalam pelarut polar seperti air (seperti dalam senyawa kovalen polar yang terionisasi). Keberadaan partikel bermuatan bebas dan mobilitasnya dalam suatu material menjadi kunci utama kemampuannya untuk menghantarkan listrik.
Lelehan Senyawa Kovalen Polar
Kemampuan suatu zat untuk menghantarkan listrik bergantung pada mobilitas pembawa muatannya. Dalam konteks ini, kita akan menelisik lebih dalam mengenai perilaku lelehan senyawa kovalen polar, yang berbeda signifikan dengan senyawa ionik dalam hal konduktivitas listrik. Fenomena ini berkaitan erat dengan struktur molekul dan interaksi antar partikel penyusunnya. Memahami perbedaan ini krusial, baik dalam konteks ilmu dasar maupun aplikasinya di dunia industri dan teknologi.
Lelehan senyawa kovalen polar, berbeda dengan senyawa ionik, tak mampu menghantarkan listrik karena kekurangan muatan bebas bergerak. Ikatan kovalennya yang kuat, walau polar, menahan ion-ion penyusunnya. Bayangkan, sehalus permainan recorder yang sering dimainkan di sekolah adalah jenis recorder , yang butuh koordinasi apik antar lubang untuk menghasilkan nada, ion dalam lelehan kovalen polar tak memiliki kebebasan serupa untuk mengalirkan arus listrik.
Oleh karena itu, kemampuan konduksi listriknya tetap rendah, sekalipun dalam keadaan cair. Intinya, ketiadaan muatan bebas inilah yang menjadi kunci mengapa lelehan senyawa kovalen polar tak menghantarkan listrik.
Ketidakmampuan Lelehan Senyawa Kovalen Polar Menghantarkan Listrik
Lelehan senyawa kovalen polar, berbeda dengan lelehan senyawa ionik, umumnya tidak dapat menghantarkan listrik. Hal ini disebabkan karena dalam senyawa kovalen polar, elektron terikat secara bersama-sama antar atom membentuk molekul netral. Tidak ada ion-ion bermuatan bebas yang dapat bergerak dan membawa arus listrik. Meskipun terdapat perbedaan kepolaran (distribusi muatan tidak merata) dalam molekul, ikatan kovalen yang relatif kuat menahan elektron tetap terikat pada molekul. Akibatnya, tidak ada pembawa muatan bebas yang signifikan untuk menghantarkan arus listrik.
Perbedaan Gerak Partikel dalam Lelehan Senyawa Kovalen Polar dan Ionik
Perbedaan kemampuan menghantarkan listrik antara lelehan senyawa kovalen polar dan ionik terletak pada sifat partikel penyusunnya. Dalam lelehan senyawa ionik, seperti NaCl, terdapat ion-ion Na+ dan Cl– yang bebas bergerak. Gerakan ion-ion bermuatan ini memungkinkan terjadinya aliran muatan listrik ketika diberi medan listrik. Sebaliknya, dalam lelehan senyawa kovalen polar, meskipun molekulnya polar, elektron tetap terikat kuat dalam molekul netral. Molekul-molekul ini bergerak secara acak, tetapi tidak membawa muatan listrik bersih yang dapat menghasilkan arus listrik yang signifikan. Interaksi antarmolekul, seperti ikatan hidrogen, hanya memengaruhi viskositas dan titik didih, bukan konduktivitas listrik.
Contoh Senyawa Kovalen Polar dan Konduktivitas Listriknya
- Air (H2O): Molekul air bersifat polar karena perbedaan elektronegativitas antara atom hidrogen dan oksigen. Namun, lelehan air (air murni) menghantarkan listrik sangat lemah karena hanya sedikit ion yang terdisosiasi. Konduktivitas listrik yang rendah ini jauh berbeda dengan konduktivitas lelehan senyawa ionik.
- Aseton (CH3COCH3): Aseton juga merupakan senyawa kovalen polar, tetapi lelehannya tidak menghantarkan listrik secara signifikan karena tidak ada ion bebas yang bergerak.
- Etanol (C2H5OH): Mirip dengan aseton, etanol merupakan senyawa kovalen polar dengan molekul netral. Lelehan etanol tidak menghantarkan listrik karena kurangnya pembawa muatan bebas.
Eksperimen Sederhana untuk Mendemonstrasikan Konduktivitas Listrik
Eksperimen sederhana dapat dilakukan untuk membandingkan konduktivitas listrik lelehan senyawa kovalen polar dan ionik. Perlengkapan yang dibutuhkan meliputi: sumber tegangan rendah (misalnya, baterai 9V), bola lampu kecil, dua elektroda (misalnya, kawat tembaga), wadah tahan panas, dan sampel senyawa ionik (misalnya, NaCl) dan senyawa kovalen polar (misalnya, air suling atau gula). Prosedur eksperimen adalah sebagai berikut:
- Siapkan rangkaian listrik sederhana dengan menghubungkan sumber tegangan, bola lampu, dan elektroda secara seri.
- Letakkan elektroda ke dalam wadah yang berisi lelehan NaCl. Amati apakah bola lampu menyala. Lampu akan menyala karena lelehan NaCl menghantarkan listrik.
- Ulangi langkah 2 dengan menggunakan lelehan senyawa kovalen polar (air suling atau gula). Amati bahwa lampu tidak menyala atau hanya menyala sangat redup, menunjukkan bahwa lelehan senyawa kovalen polar hampir tidak menghantarkan listrik.
Alasan Utama Ketidakmampuan Menghantarkan Listrik
Lelehan senyawa kovalen polar umumnya tidak menghantarkan listrik karena tidak adanya ion-ion bermuatan bebas yang dapat bergerak dan membawa arus listrik. Elektron terikat kuat dalam molekul netral, sehingga tidak ada pembawa muatan yang signifikan untuk menghantarkan arus listrik.
Peran Ion dan Elektron Bebas dalam Konduktivitas Listrik
Kemampuan suatu zat untuk menghantarkan listrik bergantung pada keberadaan dan mobilitas pembawa muatan, baik berupa ion maupun elektron bebas. Logam, misalnya, merupakan konduktor listrik yang sangat baik karena memiliki lautan elektron bebas yang dapat bergerak dengan mudah. Sebaliknya, senyawa kovalen polar, meski memiliki momen dipol, menunjukkan konduktivitas listrik yang rendah. Mari kita telusuri lebih dalam peran ion dan elektron bebas dalam fenomena ini.
Peran Ion dalam Menghantarkan Listrik
Dalam senyawa ionik, seperti natrium klorida (NaCl), atom-atom terikat melalui gaya elektrostatik antara ion bermuatan positif (kation) dan ion bermuatan negatif (anion). Ketika senyawa ionik dilelehkan atau dilarutkan dalam air, ikatan ioniknya melemah, dan ion-ion tersebut menjadi bebas bergerak. Gerakan ion-ion bermuatan ini, baik kation maupun anion, merupakan mekanisme utama konduktivitas listrik dalam lelehan senyawa ionik atau larutan elektrolit. Semakin tinggi konsentrasi ion dan mobilitasnya, semakin baik kemampuan larutan atau lelehan tersebut menghantarkan listrik. Ini menjelaskan mengapa air garam, yang mengandung ion-ion natrium dan klorida, dapat menghantarkan listrik dengan lebih baik daripada air murni.
Peran Elektron Bebas dalam Menghantarkan Listrik dalam Logam
Logam memiliki struktur atom yang unik. Elektron valensi pada atom-atom logam tidak terikat kuat pada atom induknya, melainkan terdelokalisasi dan membentuk “lautan elektron” yang mengelilingi kation logam. Elektron-elektron ini bebas bergerak di seluruh struktur logam, sehingga logam menjadi konduktor listrik yang sangat baik. Ketika beda potensial diterapkan pada logam, elektron-elektron bebas ini akan bergerak secara terarah, menghasilkan arus listrik. Kemampuan logam menghantarkan listrik ini bergantung pada jumlah elektron bebas dan mobilitasnya.
Perbandingan Pergerakan Ion dan Elektron Bebas, Lelehan senyawa kovalen polar tidak dapat menghantarkan listrik karena
Pergerakan ion dan elektron bebas dalam menghantarkan listrik memiliki perbedaan yang signifikan. Elektron bebas, dengan massanya yang jauh lebih kecil dibandingkan ion, memiliki mobilitas yang jauh lebih tinggi. Akibatnya, konduktivitas listrik dalam logam umumnya jauh lebih besar daripada dalam lelehan senyawa ionik. Selain itu, pergerakan elektron bebas lebih mudah dipengaruhi oleh medan listrik eksternal, menyebabkan respon konduktivitas yang lebih cepat dan efisien. Pergerakan ion dalam lelehan, di sisi lain, dipengaruhi oleh ukuran dan muatan ion, serta interaksi antar ion, yang dapat menghambat mobilitasnya.
Ilustrasi Pergerakan Ion dan Elektron
Bayangkan lelehan senyawa ionik sebagai sekumpulan bola bermuatan positif dan negatif yang bergerak secara acak. Penerapan medan listrik akan menyebabkan bola-bola bermuatan tersebut bergerak secara terarah, namun pergerakannya terhambat oleh interaksi antar bola. Sebaliknya, bayangkan logam sebagai lautan elektron yang bergerak bebas seperti awan elektron yang merespon medan listrik dengan cepat dan efisien. Pergerakan elektron ini lebih seperti arus air yang mengalir tanpa hambatan yang signifikan.
Senyawa Kovalen Polar dan Ketiadaan Ion atau Elektron Bebas
Senyawa kovalen polar terbentuk dari ikatan kovalen antara atom-atom dengan elektronegativitas yang berbeda, menghasilkan molekul dengan dipol. Meskipun memiliki dipol, senyawa kovalen polar tidak memiliki ion atau elektron bebas yang cukup untuk menghantarkan listrik dalam keadaan cair. Elektron-elektron dalam senyawa kovalen polar terikat kuat pada atom-atom penyusunnya, sehingga mobilitasnya sangat terbatas. Oleh karena itu, walaupun terdapat dipol, kemampuan senyawa kovalen polar untuk menghantarkan listrik sangat rendah dibandingkan dengan logam atau lelehan senyawa ionik.
Pemungkas: Lelehan Senyawa Kovalen Polar Tidak Dapat Menghantarkan Listrik Karena
Kesimpulannya, kemampuan suatu zat untuk menghantarkan listrik bergantung pada keberadaan partikel bermuatan bebas yang dapat bergerak. Senyawa kovalen polar, karena ikatan kovalennya yang kuat dan tidak adanya ion bebas, tidak memiliki partikel tersebut dalam keadaan cair. Ini menjelaskan mengapa lelehan senyawa kovalen polar merupakan isolator listrik yang baik. Pengetahuan ini krusial dalam berbagai bidang, dari industri kimia hingga teknologi material. Memahami sifat dasar materi membuka jalan untuk inovasi dan pengembangan teknologi yang lebih maju.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya