Mengapa asam bersifat korosif? Pertanyaan ini membawa kita pada dunia reaksi kimia yang dinamis dan penuh dampak. Sifat korosif asam, yang mampu merusak material, khususnya logam, merupakan fenomena yang telah lama dipelajari dan dipahami. Dari reaksi yang terjadi pada tingkat molekul hingga dampaknya yang nyata pada infrastruktur, pemahaman mendalam tentang korosivitas asam sangat krusial, baik dalam industri maupun kehidupan sehari-hari. Memahami bagaimana asam berinteraksi dengan berbagai material menjadi kunci untuk mencegah kerusakan dan kerugian ekonomi yang signifikan.
Korosivitas asam berakar pada sifat kimianya yang unik. Asam, berdasarkan teori Brønsted-Lowry, adalah zat yang melepaskan ion hidrogen (H+), sementara teori Lewis mendefinisikannya sebagai akseptor pasangan elektron. Ion H+ inilah yang berperan utama dalam proses korosi. Interaksi ion H+ dengan logam memicu reaksi redoks, di mana logam melepaskan elektron dan teroksidasi, membentuk ion logam yang larut dalam larutan asam. Proses ini berlanjut hingga material logam mengalami kerusakan struktural. Faktor-faktor seperti konsentrasi asam, suhu, jenis logam, dan keberadaan inhibitor korosi turut memengaruhi kecepatan dan tingkat kerusakan yang terjadi.
Sifat Kimia Asam dan Korosivitas: Mengapa Asam Bersifat Korosif
Sifat korosif asam, kemampuannya untuk merusak material, terutama logam, merupakan fenomena kimia yang krusial dalam berbagai konteks, dari industri hingga kehidupan sehari-hari. Pemahaman mendalam tentang sifat kimia asam dan mekanisme korosi sangat penting untuk mitigasi kerusakan dan optimalisasi proses industri. Artikel ini akan mengupas tuntas aspek kimiawi di balik sifat korosif asam.
Definisi Asam Berdasarkan Teori Brønsted-Lowry dan Lewis
Teori Brønsted-Lowry mendefinisikan asam sebagai spesi kimia yang mampu mendonorkan proton (ion H+). Semakin mudah suatu spesi mendonorkan proton, semakin kuat asam tersebut. Sementara itu, teori Lewis menawarkan definisi yang lebih luas, menyatakan asam sebagai akseptor pasangan elektron. Definisi Lewis mencakup asam Brønsted-Lowry, tetapi juga memperluas cakupan ke senyawa yang tidak memiliki proton, seperti BF3. Perbedaan pendekatan ini penting karena menjelaskan beragam reaksi asam, termasuk reaksi yang melibatkan pembentukan ikatan koordinasi.
Ion-Ion yang Terlibat dalam Proses Korosif Asam
Proses korosi asam melibatkan interaksi kompleks antara ion-ion dalam larutan asam dan permukaan logam. Ion hidrogen (H+) memainkan peran utama, berperan sebagai oksidator yang menerima elektron dari logam. Anion dalam asam, seperti Cl– atau SO42-, juga dapat berpartisipasi dalam proses korosi, misalnya dengan membentuk kompleks dengan ion logam atau meningkatkan kelarutan produk korosi. Kehadiran oksigen (O2) di udara juga dapat mempercepat proses korosi, membentuk sel elektrokimia yang mempercepat reaksi.
Mekanisme Reaksi Asam dengan Logam yang Menyebabkan Korosi
Korosi logam oleh asam merupakan reaksi redoks. Logam bertindak sebagai reduktor, melepaskan elektron dan teroksidasi menjadi ion logam. Elektron yang dilepaskan kemudian diterima oleh ion hidrogen (H+) dari asam, yang tereduksi menjadi gas hidrogen (H2). Reaksi ini dapat digambarkan secara umum sebagai berikut: M(s) + 2H+(aq) → M2+(aq) + H2(g), di mana M mewakili logam. Kecepatan reaksi dipengaruhi oleh beberapa faktor, termasuk konsentrasi asam, jenis logam, dan suhu. Proses ini seringkali menghasilkan pembentukan lapisan oksida atau garam pada permukaan logam, yang dapat melindungi atau mempercepat korosi tergantung pada sifatnya.
Sifat korosif asam disebabkan oleh ion hidrogen (H+) yang sangat reaktif, mudah bereaksi dengan logam dan merusak struktur material. Bayangkan, reaksi ini begitu kuat, bahkan aktivitas sosial sederhana seperti gotong royong membangun fasilitas umum — lihat beragam contohnya di contoh aktivitas sosial — juga bisa terhambat jika terpapar asam yang tumpah.
Kembali ke inti permasalahan, kemampuan asam untuk melarutkan material inilah yang menjadi dasar sifat korosifnya, sehingga penanganan asam harus dilakukan dengan sangat hati-hati.
Perbandingan Tingkat Korosivitas Beberapa Jenis Asam
Tingkat korosivitas asam sangat bervariasi tergantung pada kekuatan asam dan konsentrasinya. Asam kuat, seperti asam sulfat (H2SO4) dan asam nitrat (HNO3), jauh lebih korosif daripada asam lemah, seperti asam asetat (CH3COOH). Berikut perbandingan tingkat korosivitas beberapa asam:
| Asam | Kekuatan | Tingkat Korosivitas | Contoh Aplikasi/Dampak |
|---|---|---|---|
| Asam Sulfat (H2SO4) | Kuat | Sangat Tinggi | Industri kimia, baterai, pemrosesan logam (menyebabkan korosi berat pada baja) |
| Asam Nitrat (HNO3) | Kuat | Tinggi | Pembuatan pupuk, bahan peledak (dapat menyebabkan korosi pada berbagai logam, termasuk aluminium) |
| Asam Klorida (HCl) | Kuat | Tinggi | Industri kimia, pengolahan logam (sangat korosif terhadap banyak logam) |
| Asam Asetat (CH3COOH) | Lemah | Rendah | Makanan, pengawet (korosivitas relatif rendah, tetapi dapat menyebabkan korosi pada logam tertentu dalam jangka panjang) |
Contoh Reaksi Kimia Spesifik yang Menunjukkan Proses Korosi Logam Akibat Asam
Sebagai contoh, reaksi korosi besi (Fe) oleh asam klorida (HCl) dapat ditulis sebagai berikut:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Reaksi ini menunjukkan bagaimana besi bereaksi dengan asam klorida, membentuk besi(II) klorida dan gas hidrogen. Besi teroksidasi, melepaskan elektron, sementara ion hidrogen dari asam klorida tereduksi. Proses ini menghasilkan korosi pada besi, yang ditandai dengan pelepasan gas hidrogen dan pembentukan besi(II) klorida yang larut.
Faktor-faktor yang Mempengaruhi Korosivitas Asam
Sifat korosif asam, kemampuannya untuk merusak material, bukanlah fenomena tunggal melainkan interaksi kompleks berbagai faktor. Pemahaman mendalam mengenai faktor-faktor ini krusial, baik untuk mencegah kerusakan material maupun untuk mengoptimalkan penggunaan asam dalam berbagai proses industri. Dari konsentrasi asam hingga jenis logam yang terpapar, setiap variabel memainkan peran signifikan dalam menentukan seberapa cepat dan seberapa parah korosi terjadi. Berikut uraian lebih detail mengenai faktor-faktor kunci tersebut.
Sifat korosif asam berasal dari kemampuannya melepaskan ion hidrogen (H+), yang bereaksi dengan berbagai material, merusak struktur kimianya. Ini mirip dengan bagaimana faktor geografis memengaruhi persebaran penduduk; begitu mudahnya kita menemukan penjelasan mengapa penduduk cenderung terpusat di daerah dataran rendah, seperti yang dibahas di mengapa penduduk cenderung terpusat di daerah dataran rendah , kemudahan akses sumber daya dan kesuburan tanah.
Kembali ke asam, reaksi ion H+ yang agresif ini, mirip dengan tekanan demografis yang memaksa konsentrasi penduduk di area tertentu, mengakibatkan kerusakan dan degradasi material yang terpapar. Intinya, baik fenomena alam maupun reaksi kimia, konsentrasi dan interaksi menentukan dampaknya.
Pengaruh Konsentrasi Asam terhadap Korosivitas
Konsentrasi asam merupakan faktor penentu utama tingkat korosivitas. Semakin tinggi konsentrasi asam, semakin besar jumlah ion hidrogen (H+) yang tersedia untuk bereaksi dengan logam. Ion H+ inilah yang memicu reaksi oksidasi-reduksi yang menyebabkan korosi. Sebagai ilustrasi, asam sulfat pekat (98%) jauh lebih korosif dibandingkan asam sulfat encer (10%). Hal ini karena jumlah ion H+ yang lebih tinggi pada larutan pekat memungkinkan reaksi korosi berlangsung lebih cepat dan agresif. Perbedaannya sangat signifikan, sehingga penanganan asam pekat memerlukan prosedur keselamatan yang jauh lebih ketat.
Pengaruh Suhu terhadap Kecepatan Reaksi Korosi Asam
Suhu berperan penting dalam menentukan kecepatan reaksi kimia, termasuk reaksi korosi. Peningkatan suhu umumnya meningkatkan energi kinetik partikel, sehingga frekuensi tumbukan antara ion H+ dan permukaan logam meningkat. Konsekuensinya, laju reaksi korosi juga meningkat secara eksponensial. Bayangkan sebuah percobaan sederhana: sepotong besi akan berkarat jauh lebih cepat dalam air panas yang diasamkan dibandingkan dalam air dingin yang diasamkan. Ini menunjukkan bagaimana peningkatan suhu mempercepat proses korosi secara drastis.
Peran Jenis Logam yang Terkena Asam dalam Proses Korosif
Tidak semua logam bereaksi sama terhadap asam. Deret aktivitas logam menjelaskan kecenderungan relatif logam untuk mengalami oksidasi. Logam yang berada di posisi lebih tinggi dalam deret aktivitas lebih mudah teroksidasi dan karenanya lebih rentan terhadap korosi asam. Sebagai contoh, besi (Fe) lebih mudah terkorosi oleh asam dibandingkan emas (Au). Sifat kimiawi permukaan logam, seperti keberadaan lapisan oksida pelindung, juga mempengaruhi tingkat korosivitas. Logam-logam tertentu, seperti aluminium, meskipun reaktif, bisa membentuk lapisan oksida pelindung yang mencegah korosi lebih lanjut, fenomena yang dikenal sebagai pasivasi.
Pengaruh Inhibitor Korosi dalam Mengurangi Efek Korosif Asam
Inhibitor korosi adalah zat-zat yang ditambahkan ke dalam larutan asam untuk mengurangi laju korosi. Mereka bekerja melalui berbagai mekanisme, seperti membentuk lapisan pelindung pada permukaan logam, menyerap ion agresif, atau mengubah mekanisme reaksi korosi. Beberapa contoh inhibitor korosi yang umum digunakan meliputi senyawa organik seperti amin dan imidazol, serta senyawa anorganik seperti kromat dan nitrit. Penggunaan inhibitor korosi sangat penting dalam industri untuk melindungi peralatan dan infrastruktur dari kerusakan akibat korosi asam.
- Membentuk lapisan pelindung pada permukaan logam, menghalangi kontak langsung antara logam dan asam.
- Menyerap ion agresif dalam larutan asam, mengurangi konsentrasi ion yang menyebabkan korosi.
- Mengubah mekanisme reaksi korosi, sehingga laju reaksi menjadi lebih lambat.
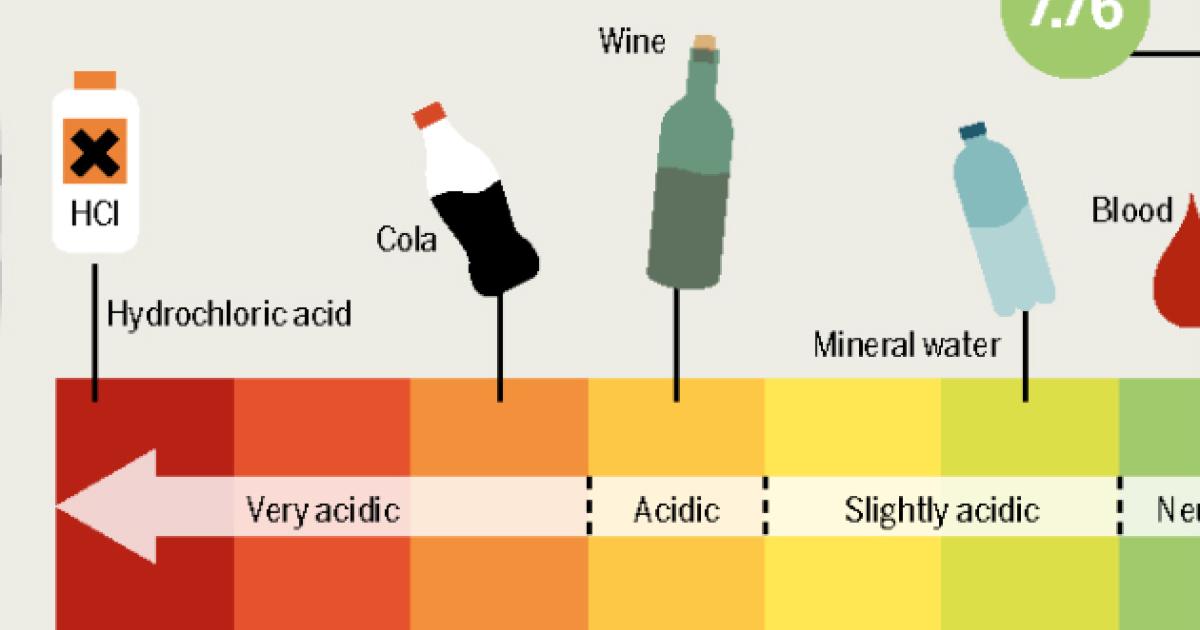
Pengaruh pH Larutan Asam terhadap Laju Korosi, Mengapa asam bersifat korosif
pH larutan asam secara langsung berhubungan dengan konsentrasi ion hidrogen (H+). Semakin rendah nilai pH (semakin asam larutan), semakin tinggi konsentrasi ion H+, dan semakin cepat laju korosi. Larutan asam kuat dengan pH mendekati 0 akan menunjukkan laju korosi yang jauh lebih tinggi dibandingkan larutan asam lemah dengan pH mendekati 7. Pengukuran pH merupakan parameter penting dalam mengontrol dan memprediksi tingkat korosi dalam berbagai aplikasi industri.
Reaksi Korosif Asam: Mekanisme dan Contoh

Sifat korosif asam merupakan fenomena kimia yang krusial, berpengaruh signifikan terhadap berbagai aspek kehidupan, dari kerusakan infrastruktur hingga proses industri. Pemahaman mendalam tentang reaksi korosi asam sangat penting untuk mitigasi dampak negatifnya dan pemanfaatannya yang bertanggung jawab. Berikut beberapa contoh reaksi korosif asam yang umum terjadi.
Reaksi Asam Klorida (HCl) dengan Besi (Fe)
Asam klorida, sebagai asam kuat, bereaksi hebat dengan besi. Reaksi ini menghasilkan besi(II) klorida dan gas hidrogen. Prosesnya diawali dengan serangan ion hidrogen (H+) pada permukaan besi, melepaskan elektron dan membentuk ion besi(II) (Fe2+). Elektron yang dilepaskan kemudian mereduksi ion hidrogen menjadi gas hidrogen. Persamaan reaksi yang seimbang adalah:
2HCl(aq) + Fe(s) → FeCl2(aq) + H2(g)
Reaksi ini bersifat eksotermis, menghasilkan panas. Kecepatan reaksi dipengaruhi oleh konsentrasi asam, luas permukaan besi, dan suhu. Korosi pada besi akibat HCl terlihat sebagai perubahan warna dan tekstur permukaan logam, menjadi lebih rapuh dan mudah hancur.
Korosi Tembaga (Cu) oleh Asam Nitrat (HNO3)
Tembaga, meskipun relatif tahan terhadap korosi dibandingkan besi, dapat bereaksi dengan asam nitrat pekat. Reaksi ini lebih kompleks daripada reaksi besi dengan HCl, menghasilkan berbagai produk tergantung konsentrasi asam nitrat. Pada konsentrasi pekat, reaksi menghasilkan tembaga(II) nitrat, nitrogen dioksida (gas berwarna cokelat kemerahan), dan air. Prosesnya melibatkan oksidasi tembaga oleh ion nitrat (NO3–), yang direduksi menjadi NO2.
Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O(l)
Gas NO2 yang dihasilkan bersifat toksik dan berbahaya bagi kesehatan. Korosi tembaga oleh HNO3 ditandai dengan munculnya warna kehijauan atau kebiruan pada permukaan logam, menunjukkan pembentukan tembaga(II) nitrat.
Reaksi Asam Sulfat (H2SO4) dengan Seng (Zn)
Asam sulfat juga merupakan asam kuat yang bereaksi dengan seng menghasilkan seng sulfat dan gas hidrogen. Reaksi ini mirip dengan reaksi HCl dengan besi, melibatkan pelepasan elektron oleh seng dan reduksi ion hidrogen. Produk reaksi berupa larutan seng sulfat yang jernih dan gas hidrogen yang mudah terbakar.
Sifat korosif asam berasal dari kemampuannya melepaskan ion hidrogen (H+), yang bereaksi dengan logam dan material lain, merusak struktur mereka. Bayangkan kekuatannya seperti serangan bertubi-tubi dalam pertandingan olahraga beladiri asli indonesia adalah , yang menunjukkan kekuatan dan ketahanan tubuh manusia. Namun, kekuatan asam jauh lebih destruktif, karena reaksi kimiawi yang terjadi secara mikroskopis menghancurkan ikatan material secara perlahan tapi pasti, layaknya karat yang menggerogoti besi.
Intinya, kemampuan asam untuk mengikis berasal dari reaksi kimia yang agresif dan tidak dapat dihentikan sebelum seluruh proses berakhir.
H2SO4(aq) + Zn(s) → ZnSO4(aq) + H2(g)
Kecepatan reaksi dapat ditingkatkan dengan memanaskan larutan atau menggunakan asam sulfat yang lebih pekat. Perubahan fisika yang terlihat adalah hilangnya logam seng dan munculnya gelembung gas hidrogen.
Dampak Korosif Asam terhadap Infrastruktur Logam
Korosi asam pada infrastruktur logam seperti jembatan, gedung, dan pipa menyebabkan kerusakan struktural yang signifikan. Kerusakan ini tidak hanya mengurangi umur pakai infrastruktur, tetapi juga menimbulkan risiko keselamatan dan kerugian ekonomi yang besar. Perawatan dan perlindungan yang tepat terhadap infrastruktur logam dari paparan asam sangat penting untuk mencegah korosi dan memastikan keselamatan publik.
Ilustrasi Reaksi Asam Klorida dan Aluminium
Reaksi antara asam klorida dan aluminium menghasilkan aluminium klorida dan gas hidrogen. Secara visual, kita akan melihat logam aluminium yang mengkilap secara bertahap larut dalam larutan asam klorida. Perubahan kimia ditandai dengan pembentukan ion aluminium (Al3+) dan ion klorida (Cl–) dalam larutan. Perubahan fisika terlihat dari hilangnya massa aluminium, munculnya gelembung gas hidrogen, dan peningkatan suhu larutan (karena reaksi eksotermis). Permukaan aluminium akan tampak kusam dan berlubang seiring berjalannya reaksi. Reaksi ini dapat digambarkan sebagai berikut:
6HCl(aq) + 2Al(s) → 2AlCl3(aq) + 3H2(g)
Pencegahan dan Pengendalian Korosif Asam
Korosi asam, musuh laten industri, tak hanya merugikan secara finansial namun juga mengancam keselamatan kerja. Kerusakan akibat korosi berdampak luas, mulai dari penurunan efisiensi peralatan hingga potensi kecelakaan yang fatal. Oleh karena itu, pencegahan dan pengendalian korosi asam menjadi krusial, membutuhkan strategi komprehensif yang terintegrasi.
Metode Pencegahan Korosif Asam pada Logam
Berbagai metode dapat diimplementasikan untuk mencegah korosi asam pada logam, semuanya bertujuan untuk meminimalisir kontak antara permukaan logam dengan asam atau menciptakan penghalang yang efektif. Pilihan metode yang tepat bergantung pada jenis logam, jenis asam, dan kondisi lingkungan operasional.
- Pelapisan pelindung: Metode ini menciptakan lapisan penghalang antara logam dan asam. Contohnya, pelapisan dengan cat khusus tahan asam, lapisan polimer, atau logam lain yang lebih tahan korosi (seperti stainless steel).
- Proteksi katodik: Teknik ini menggunakan arus listrik untuk melindungi logam dari korosi. Logam yang dilindungi dihubungkan ke anoda yang akan terkorbankan, sehingga arus listrik mengalir dari anoda ke katoda (logam yang dilindungi), mencegah terjadinya reaksi korosi pada katoda.
- Modifikasi lingkungan: Mengurangi konsentrasi asam, mengurangi suhu operasi, atau mengontrol pH lingkungan dapat secara signifikan mengurangi laju korosi. Penggunaan sistem tertutup juga membantu meminimalisir paparan asam ke udara dan peralatan.
Perlindungan Logam Melalui Pelapisan
Pelapisan logam merupakan strategi kunci dalam mencegah korosi asam. Lapisan pelindung bertindak sebagai penghalang fisik, mencegah asam mencapai permukaan logam dasar. Keefektifan pelapisan bergantung pada kualitas lapisan, ketebalan, dan ketahanan lapisan terhadap asam spesifik yang digunakan. Jenis pelapisan yang dipilih akan mempertimbangkan faktor ekonomi dan ketahanan terhadap lingkungan kerja yang spesifik.
- Galvanisasi: Pelapisan dengan seng (Zn) yang umum digunakan untuk melindungi baja dari korosi. Seng lebih reaktif daripada baja, sehingga akan teroksidasi lebih dulu, melindungi baja di bawahnya.
- Chrome plating: Pelapisan dengan kromium (Cr) memberikan lapisan keras, tahan korosi, dan mengkilap. Sering digunakan pada komponen otomotif dan industri lainnya.
- Electroplating: Proses elektrokimia yang melapisi logam dengan lapisan tipis logam lain. Ketebalan dan kualitas lapisan dapat dikontrol dengan presisi.
Mekanisme Kerja Inhibitor Korosif dan Contohnya
Inhibitor korosi adalah zat yang ditambahkan ke dalam lingkungan asam untuk mengurangi laju korosi. Inhibitor bekerja dengan berbagai mekanisme, misalnya dengan membentuk lapisan pelindung pada permukaan logam, menghalangi reaksi elektrokimia korosi, atau dengan menyerap ion-ion agresif yang menyebabkan korosi. Pemilihan inhibitor yang tepat sangat penting karena efektifitasnya bergantung pada jenis logam dan asam yang terlibat.
- Inhibitor anoda: Menghambat reaksi oksidasi pada anoda. Contoh: Kromat, nitrit.
- Inhibitor katodik: Menghambat reaksi reduksi pada katoda. Contoh: Arsenit, sulfida.
- Inhibitor campuran: Menghambat reaksi baik pada anoda maupun katoda. Contoh: Amina, molibdat.
Metode Pencegahan Korosif Asam: Perbandingan
| Metode | Kelebihan | Kekurangan | Biaya |
|---|---|---|---|
| Pelapisan | Perlindungan efektif, tahan lama | Biaya tinggi untuk beberapa jenis pelapisan, dapat terkelupas | Tinggi – Sedang |
| Proteksi Katodik | Perlindungan efektif, dapat diterapkan pada struktur besar | Membutuhkan sumber daya listrik, perawatan berkala | Sedang – Tinggi |
| Inhibitor Korosif | Relatif murah, mudah diaplikasikan | Efektivitas terbatas, beberapa inhibitor bersifat toksik | Rendah – Sedang |
| Modifikasi Lingkungan | Menghindari penggunaan bahan kimia agresif | Tidak selalu praktis, dapat meningkatkan biaya produksi | Sedang – Tinggi |
Pentingnya pemeliharaan dan perawatan berkala tidak dapat diabaikan. Inspeksi rutin, pembersihan, dan perbaikan segera kerusakan kecil dapat mencegah korosi asam berkembang menjadi masalah yang lebih besar dan mahal. Program pemeliharaan yang terencana akan secara signifikan memperpanjang umur pakai peralatan industri dan mengurangi biaya operasional jangka panjang.
Penutup

Kesimpulannya, sifat korosif asam merupakan konsekuensi langsung dari kemampuannya melepaskan ion hidrogen yang reaktif. Reaksi ini, yang melibatkan transfer elektron dan pembentukan senyawa baru, menyebabkan degradasi material, terutama logam. Memahami mekanisme korosi asam dan faktor-faktor yang mempengaruhinya sangat penting untuk pengembangan strategi pencegahan yang efektif. Dari penggunaan inhibitor korosi hingga teknik pelapisan logam, berbagai metode telah dikembangkan untuk melindungi material dari dampak merusak asam. Penelitian dan inovasi terus berlanjut untuk menemukan solusi yang lebih efisien dan berkelanjutan dalam menghadapi tantangan korosi asam ini, demi menjaga keamanan dan ketahanan infrastruktur serta berbagai peralatan industri.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya