Mengapa konsentrasi enzim dan substrat memengaruhi kerja enzim? Pertanyaan ini mendasar dalam memahami reaksi biokimiawi di dalam tubuh makhluk hidup, bahkan hingga dalam proses industri makanan dan bioteknologi. Bayangkan sebuah pabrik kecil di dalam sel, di mana enzim bertindak sebagai pekerja dan substrat sebagai bahan baku. Jumlah pekerja (enzim) dan bahan baku (substrat) akan sangat menentukan seberapa cepat produk dihasilkan. Ketersediaan enzim yang memadai, dengan jumlah substrat yang optimal, akan menghasilkan proses yang efisien dan cepat. Sebaliknya, kekurangan salah satu atau keduanya akan mengakibatkan proses yang lambat, bahkan terhenti. Pemahaman mendalam mengenai interaksi ini penting untuk mengoptimalkan berbagai proses biologis dan industri.
Konsentrasi enzim dan substrat merupakan faktor kunci yang menentukan kecepatan reaksi enzimatis. Semakin banyak enzim yang tersedia, semakin banyak kompleks enzim-substrat yang terbentuk, sehingga reaksi berlangsung lebih cepat hingga mencapai titik jenuh. Begitu pula dengan substrat; peningkatan konsentrasi substrat akan meningkatkan kecepatan reaksi hingga mencapai kecepatan maksimum (Vmax). Namun, hubungan ini tidaklah linier dan dipengaruhi oleh berbagai faktor lain, seperti suhu, pH, dan keberadaan inhibitor atau aktivator. Mempelajari dinamika ini membuka jalan bagi inovasi di berbagai bidang, dari pengembangan obat hingga optimasi proses fermentasi.
Pengaruh Konsentrasi Enzim terhadap Kerja Enzim: Mengapa Konsentrasi Enzim Dan Substrat Memengaruhi Kerja Enzim
Enzim, sebagai biokatalisator, berperan krusial dalam mempercepat reaksi biokimia di dalam sel. Kecepatan reaksi enzimatis ini, tak lepas dari pengaruh konsentrasi enzim dan substrat. Memahami hubungan keduanya vital untuk mengoptimalkan berbagai proses biologis, mulai dari metabolisme hingga produksi biofarmasi. Artikel ini akan mengupas tuntas pengaruh konsentrasi enzim terhadap kecepatan reaksi enzimatis.
Hubungan Jumlah Enzim dan Kecepatan Reaksi Enzimatis
Secara umum, peningkatan konsentrasi enzim berbanding lurus dengan peningkatan kecepatan reaksi enzimatis. Semakin banyak enzim yang tersedia, semakin banyak molekul substrat yang dapat diikat dan diubah menjadi produk dalam waktu tertentu. Bayangkan sebuah pabrik dengan mesin-mesin (enzim) yang memproses bahan baku (substrat). Semakin banyak mesin, semakin banyak bahan baku yang dapat diolah dalam waktu yang sama. Namun, hubungan ini bukanlah linier tanpa batas, seperti yang akan kita lihat selanjutnya.
Grafik Hubungan Konsentrasi Enzim dan Kecepatan Reaksi
Grafik hubungan antara konsentrasi enzim dan kecepatan reaksi umumnya berbentuk hiperbola. Fase awal menunjukkan peningkatan kecepatan reaksi yang signifikan seiring dengan peningkatan konsentrasi enzim. Ini karena masih banyak substrat yang tersedia untuk diikat oleh enzim. Namun, pada konsentrasi enzim tertentu, kecepatan reaksi akan mencapai titik plateau (jenuh). Pada fase ini, penambahan enzim selanjutnya tidak akan meningkatkan kecepatan reaksi secara signifikan. Semua enzim telah bekerja secara maksimal dan substrat menjadi faktor pembatas.
Ilustrasi grafiknya menunjukkan kurva yang naik tajam di awal, lalu melandai dan mendekati garis horizontal. Bagian awal yang curam menggambarkan peningkatan kecepatan reaksi yang proporsional terhadap penambahan enzim. Bagian datar menandakan titik jenuh, di mana penambahan enzim tidak lagi berpengaruh signifikan terhadap kecepatan reaksi karena keterbatasan substrat.
Perbandingan Kecepatan Reaksi pada Berbagai Konsentrasi Enzim
| Konsentrasi Enzim | Kecepatan Reaksi | Penjelasan |
|---|---|---|
| Rendah | Rendah | Terbatasnya jumlah enzim menyebabkan sedikit substrat yang diproses dalam waktu tertentu. |
| Sedang | Sedang | Jumlah enzim cukup untuk memproses sebagian besar substrat, kecepatan reaksi meningkat signifikan. |
| Tinggi | Tinggi (mendekati jenuh) | Hampir semua substrat telah terikat dan diproses oleh enzim, peningkatan kecepatan reaksi minimal. |
Faktor-Faktor Lain yang Mempengaruhi Kecepatan Reaksi Enzimatis
Selain konsentrasi enzim, beberapa faktor lain juga berpengaruh signifikan terhadap kecepatan reaksi enzimatis. Faktor-faktor ini mencakup konsentrasi substrat, suhu, pH, dan keberadaan inhibitor atau aktivator. Suhu yang terlalu tinggi atau rendah dapat merusak struktur enzim (denaturasi), sementara pH yang tidak optimal dapat mengubah konformasi enzim dan mengurangi aktivitasnya. Inhibitor menghambat kerja enzim, sedangkan aktivator meningkatkannya. Interaksi kompleks antara faktor-faktor ini menentukan kecepatan reaksi secara keseluruhan. Sebagai contoh, dalam industri fermentasi, pengaturan suhu dan pH menjadi kunci untuk mencapai hasil optimal.
Pengaruh Penambahan Enzim Terus-Menerus Hingga Titik Jenuh
Grafik yang menggambarkan pengaruh penambahan enzim secara terus menerus akan menunjukkan kurva hiperbola. Pada awalnya, penambahan enzim menyebabkan peningkatan kecepatan reaksi yang drastis. Namun, seiring dengan peningkatan konsentrasi enzim, kurva akan semakin melandai hingga mencapai titik jenuh (plateau). Pada titik ini, penambahan enzim lebih lanjut tidak akan meningkatkan kecepatan reaksi secara signifikan karena semua substrat telah terikat oleh enzim yang ada. Analogi sederhana adalah sebuah restoran dengan sejumlah meja terbatas. Meskipun jumlah pelayan (enzim) ditambah, kecepatan pelayanan (reaksi) tidak akan meningkat secara signifikan jika semua meja telah terisi (substrat terbatas).
Efisiensi kerja enzim, ibarat mesin di pabrik, sangat bergantung pada ketersediaan bahan baku (substrat) dan jumlah mesin (enzim) yang beroperasi. Konsentrasi substrat yang tinggi memungkinkan enzim bekerja maksimal, layaknya pabrik yang mendapat pasokan bahan mentah melimpah. Namun, peningkatan jumlah enzim hingga titik tertentu juga meningkatkan kecepatan reaksi, sebagaimana Universitas Pertamina dengan akreditasi -nya yang mumpuni menunjukkan kapasitas sumber daya manusia yang memadai.
Sebaliknya, kekurangan substrat atau enzim akan menghambat proses, menyerupai pabrik yang kekurangan bahan baku atau tenaga kerja. Singkatnya, keseimbangan antara konsentrasi enzim dan substrat adalah kunci optimalisasi kerja enzim.
Pengaruh Konsentrasi Substrat terhadap Kerja Enzim
Enzim, sebagai biokatalisator, berperan krusial dalam berbagai reaksi biokimia. Efisiensi kerja enzim sangat dipengaruhi oleh beberapa faktor, salah satunya adalah konsentrasi substrat. Pemahaman mendalam tentang hubungan antara konsentrasi substrat dan aktivitas enzimatis penting dalam berbagai bidang, mulai dari industri farmasi hingga rekayasa genetika. Artikel ini akan mengupas tuntas bagaimana konsentrasi substrat memengaruhi kecepatan reaksi enzimatis, sebuah aspek fundamental dalam biologi molekuler dan biokimia.
Pembentukan Kompleks Enzim-Substrat
Konsentrasi substrat secara langsung berbanding lurus dengan peluang terjadinya interaksi antara enzim dan substrat. Semakin tinggi konsentrasi substrat, semakin besar kemungkinan molekul substrat berikatan dengan sisi aktif enzim, membentuk kompleks enzim-substrat. Kompleks inilah yang menjadi kunci dimulainya reaksi enzimatis. Bayangkan hal ini seperti sebuah pesta: semakin banyak tamu (substrat) yang hadir, semakin besar kemungkinan mereka berinteraksi dengan tuan rumah (enzim) dan memulai percakapan (reaksi).
Efisiensi enzim, sang katalis reaksi biokimia, sangat bergantung pada konsentrasi enzim dan substratnya. Bayangkan, semakin banyak enzim, semakin banyak reaksi yang bisa dikatalisis, seperti guru yang mengajar banyak siswa. Namun, analogi ini berbeda dengan pemahaman mengenai guru wilangan, yang penjelasannya bisa ditemukan di kang diarani guru wilangan yaiku.
Kembali ke enzim, jika substrat melimpah, semua enzim akan sibuk bekerja. Sebaliknya, jika substrat terbatas, aktivitas enzim akan terhambat, sehingga efektivitas katalisis menurun. Intinya, keseimbangan konsentrasi keduanya menentukan kecepatan reaksi enzimatis.
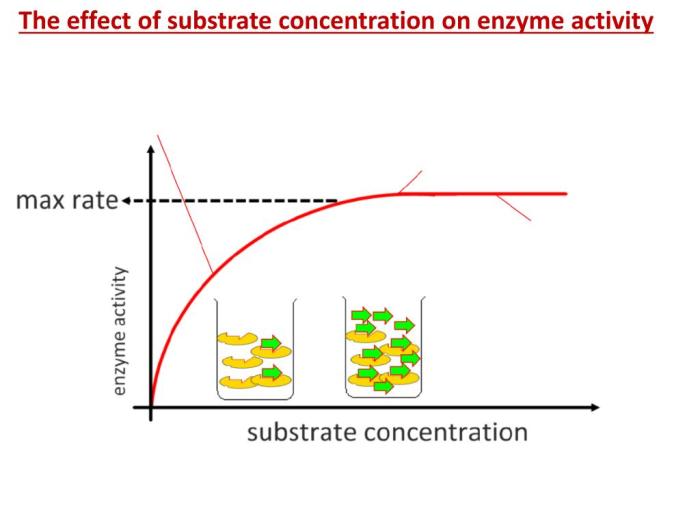
Hubungan Konsentrasi Substrat dan Kecepatan Reaksi Enzimatis
Grafik hubungan antara konsentrasi substrat dan kecepatan reaksi enzimatis umumnya berbentuk hiperbola. Grafik ini terbagi menjadi tiga fase: fase awal menunjukkan peningkatan kecepatan reaksi secara eksponensial seiring peningkatan konsentrasi substrat. Pada fase ini, sebagian besar enzim masih tersedia untuk mengikat substrat. Fase kedua menunjukan peningkatan kecepatan reaksi yang mulai melambat. Ini terjadi karena sebagian besar sisi aktif enzim telah terikat substrat, sehingga penambahan substrat tidak lagi meningkatkan kecepatan reaksi secara signifikan. Fase ketiga menunjukan kecepatan reaksi yang mendekati nilai maksimal (Vmax) dan relatif konstan meskipun konsentrasi substrat terus ditingkatkan. Pada fase ini, semua sisi aktif enzim telah terisi substrat.
Perbandingan Kecepatan Reaksi pada Berbagai Konsentrasi Substrat
| Konsentrasi Substrat | Kecepatan Reaksi | Penjelasan |
|---|---|---|
| Rendah | Rendah | Banyak enzim yang masih tersedia, namun sedikit substrat yang tersedia untuk berikatan. |
| Sedang | Sedang-tinggi | Sebagian besar enzim telah berikatan dengan substrat, kecepatan reaksi meningkat signifikan. |
| Tinggi | Mencapai Vmax (konstan) | Semua sisi aktif enzim telah terisi substrat. Penambahan substrat selanjutnya tidak akan meningkatkan kecepatan reaksi. |
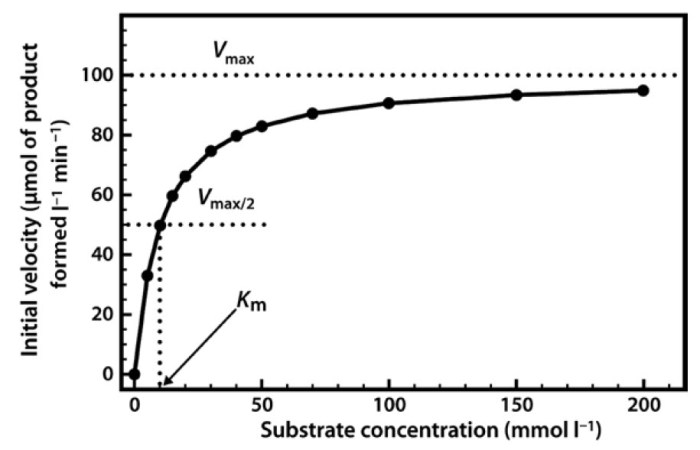
Konsep Vmax dan Km
Vmax mewakili kecepatan reaksi maksimal yang dapat dicapai oleh enzim pada konsentrasi substrat yang sangat tinggi. Sementara itu, Km (konstanta Michaelis-Menten) merepresentasikan konsentrasi substrat yang dibutuhkan untuk mencapai setengah dari Vmax. Nilai Km memberikan indikasi afinitas enzim terhadap substratnya: Km yang rendah menunjukkan afinitas yang tinggi, sementara Km yang tinggi menunjukkan afinitas yang rendah.
Ilustrasi Grafik Penambahan Substrat hingga Vmax
Bayangkan sebuah grafik dengan sumbu X mewakili konsentrasi substrat dan sumbu Y mewakili kecepatan reaksi. Grafik dimulai dari titik asal (0,0), kemudian naik secara tajam (fase eksponensial), lalu peningkatannya melambat (fase transisi), dan akhirnya mencapai plateau (fase jenuh) pada nilai Vmax. Kurva ini membentuk hiperbola, menggambarkan bagaimana penambahan substrat secara terus-menerus mempengaruhi kecepatan reaksi hingga mencapai batas maksimalnya, yaitu Vmax. Pada titik ini, semua molekul enzim telah berikatan dengan substrat, sehingga penambahan substrat lebih lanjut tidak akan meningkatkan kecepatan reaksi lagi.
Efisiensi kerja enzim, seperti halnya kinerja sistem di sekolah, sangat dipengaruhi oleh beberapa faktor. Konsentrasi enzim yang rendah ibarat tenaga pengajar yang kurang, hasilnya pun tak maksimal. Sebaliknya, substrat yang melimpah mirip siswa yang antusias mengikuti pembelajaran. Namun, jika tenaga pengajar terlalu sedikit, walaupun siswa antusias, proses belajar mengajar tetap terhambat.
Perlu diingat juga peran penting guru bimbingan dan konseling, seperti yang dijelaskan di guru bp adalah situs tersebut, dalam mengoptimalkan proses pembelajaran. Analogi ini menunjukkan bagaimana keseimbangan konsentrasi enzim dan substrat menentukan kecepatan reaksi enzimatis; kekurangan salah satunya akan menurunkan efisiensi keseluruhan proses, layaknya sekolah yang kekurangan guru atau siswa yang kurang antusias.
Interaksi Konsentrasi Enzim dan Substrat
Kecepatan reaksi enzimatis, jantung dari banyak proses biologis dan industri, sangat dipengaruhi oleh konsentrasi enzim dan substrat. Pemahaman mendalam tentang interaksi keduanya krusial, baik untuk mengoptimalkan proses fermentasi dalam industri makanan hingga merancang terapi obat yang lebih efektif dalam bioteknologi. Artikel ini akan mengurai bagaimana konsentrasi enzim dan substrat berinteraksi, menjelaskan dampaknya pada kecepatan reaksi, dan memberikan contoh praktis penerapannya.
Pengaruh Konsentrasi Enzim dan Substrat terhadap Kecepatan Reaksi
Kecepatan reaksi enzimatis meningkat seiring peningkatan konsentrasi enzim, asalkan substrat tersedia dalam jumlah cukup. Sebaliknya, peningkatan konsentrasi substrat akan meningkatkan kecepatan reaksi hingga mencapai titik jenuh, di mana semua enzim telah terikat substrat. Setelah titik jenuh, penambahan substrat tidak akan lagi meningkatkan kecepatan reaksi secara signifikan. Ini karena semua situs aktif enzim telah terisi. Hubungan ini sering digambarkan dengan kurva Michaelis-Menten, yang menunjukkan peningkatan kecepatan reaksi secara hiperbolik seiring peningkatan konsentrasi substrat pada konsentrasi enzim konstan.
Contoh Konsentrasi Enzim Tinggi Tidak Selalu Meningkatkan Kecepatan Reaksi
Bayangkan proses pembuatan keju. Meskipun menambahkan lebih banyak enzim rennet (yang mengkoagulasi susu) mungkin tampak meningkatkan kecepatan pembentukan dadih, ada batasnya. Menambahkan rennet secara berlebihan justru dapat menghambat proses dan menghasilkan tekstur keju yang kurang diinginkan. Hal ini disebabkan oleh faktor-faktor lain yang membatasi proses, seperti suhu, pH, dan ketersediaan substrat (kasein dalam susu). Kondisi optimal perlu dipertimbangkan untuk mencapai hasil yang diinginkan. Analogi serupa dapat ditemukan dalam produksi biofuel, di mana penambahan enzim secara berlebihan tidak selalu menghasilkan peningkatan produksi bioetanol secara linier.
Diagram Alir Pembentukan Produk Enzimatis, Mengapa konsentrasi enzim dan substrat memengaruhi kerja enzim
Berikut diagram alir yang menyederhanakan proses pembentukan produk enzimatis, memperlihatkan pengaruh konsentrasi enzim dan substrat pada setiap tahap:
- Substrat bebas: Konsentrasi substrat tinggi meningkatkan peluang terjadinya interaksi dengan enzim.
- Pengikatan Substrat: Konsentrasi enzim tinggi mempercepat pengikatan substrat ke situs aktif enzim.
- Kompleks Enzim-Substrat: Tahap ini berlangsung cepat jika konsentrasi enzim dan substrat tinggi.
- Konversi Substrat menjadi Produk: Kecepatan konversi bergantung pada aktivitas katalitik enzim, yang dipengaruhi oleh konsentrasi enzim.
- Pelepasan Produk: Konsentrasi produk yang tinggi dapat menghambat pelepasan produk selanjutnya, memperlambat keseluruhan proses.
Rancangan Percobaan Pengaruh Konsentrasi Enzim dan Substrat
Percobaan sederhana dapat dilakukan menggunakan enzim katalase dan substrat hidrogen peroksida (H₂O₂). Ukur volume oksigen yang dihasilkan sebagai indikator kecepatan reaksi. Variasikan konsentrasi enzim dan substrat secara terpisah, menjaga variabel lainnya konstan (suhu, pH). Ukur volume oksigen yang dihasilkan pada interval waktu tertentu. Data yang diperoleh dapat digambarkan dalam grafik untuk menunjukkan pengaruh konsentrasi enzim dan substrat terhadap kecepatan reaksi. Perlu diperhatikan bahwa kontrol eksperimen yang tepat sangat penting untuk memastikan hasil yang akurat dan dapat diandalkan.
Implikasi Praktis Pemahaman Interaksi Konsentrasi Enzim dan Substrat
Pengoptimalan proses enzimatis sangat bergantung pada pemahaman mendalam tentang interaksi konsentrasi enzim dan substrat. Di industri makanan, hal ini penting untuk mengontrol proses fermentasi, meningkatkan efisiensi produksi, dan memastikan kualitas produk akhir. Di bioteknologi, pemahaman ini berperan dalam pengembangan bioproses yang lebih efisien dan ramah lingkungan, termasuk produksi obat-obatan dan biofuel.
Faktor-faktor Lain yang Mempengaruhi Kerja Enzim
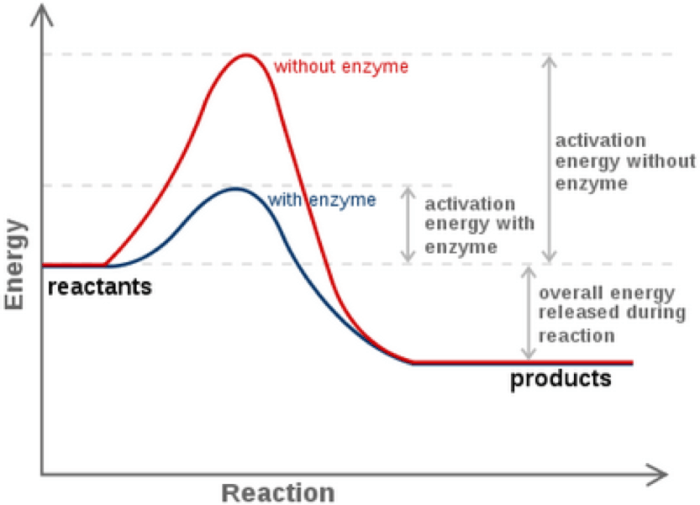
Konsentrasi enzim dan substrat memang krusial, namun kinerja enzim ibarat orkestra—bergantung pada harmoni berbagai faktor. Suhu ruangan yang terlalu panas atau dingin, tingkat keasaman (pH) yang tak sesuai, hingga kehadiran molekul pengganggu—semuanya dapat mempengaruhi “lagu” enzim, yakni kecepatan reaksi yang dikatalisisnya. Pemahaman menyeluruh tentang faktor-faktor ini penting untuk mengoptimalkan reaksi biokimia, baik di laboratorium maupun dalam tubuh kita sendiri.
Selain konsentrasi enzim dan substrat, beberapa faktor lingkungan dan molekul lain turut menentukan efisiensi kerja enzim. Perubahan kecil pada faktor-faktor ini bisa berdampak signifikan terhadap kecepatan reaksi, bahkan hingga menyebabkan enzim kehilangan fungsinya sama sekali. Mari kita telusuri lebih dalam.
Pengaruh Suhu terhadap Aktivitas Enzim
Suhu berperan sebagai penentu irama kerja enzim. Pada suhu optimal, enzim bekerja paling efisien. Namun, suhu yang terlalu tinggi dapat menyebabkan denaturasi, yaitu perubahan struktur tiga dimensi enzim yang mengakibatkan hilangnya aktivitas katalitik. Bayangkan protein enzim sebagai gulungan benang yang rapi; panas yang berlebihan akan mengurai gulungan tersebut, merusak bentuk dan fungsinya. Sebaliknya, suhu yang terlalu rendah memperlambat gerakan molekul, sehingga mengurangi frekuensi tumbukan antara enzim dan substrat, dan menurunkan kecepatan reaksi. Sebagai contoh, enzim amilase dalam saliva manusia bekerja optimal pada suhu sekitar 37°C (suhu tubuh). Pada suhu di atas 40°C, aktivitas amilase akan menurun drastis karena denaturasi.
Pengaruh pH terhadap Aktivitas Enzim
Sama halnya dengan suhu, pH juga mempengaruhi struktur dan fungsi enzim. Setiap enzim memiliki rentang pH optimal. Perubahan pH di luar rentang ini dapat mengubah muatan ionik pada gugus asam amino enzim, mengganggu ikatan hidrogen dan interaksi lainnya yang menjaga struktur tiga dimensinya. Akibatnya, struktur enzim berubah, dan aktivitas katalitiknya menurun atau hilang. Pepsin, enzim pencernaan protein di lambung, bekerja optimal pada pH asam (sekitar 2), sedangkan tripsin di usus halus lebih menyukai pH netral (sekitar 7). Perubahan pH yang signifikan dari kondisi optimal ini akan menghambat kerja kedua enzim tersebut.
Pengaruh Inhibitor dan Aktivator terhadap Aktivitas Enzim
Molekul-molekul tertentu dapat memengaruhi aktivitas enzim, baik dengan menghambat (inhibitor) maupun meningkatkan (aktivator) kecepatan reaksi. Inhibitor bekerja dengan mengikat enzim dan mencegahnya berikatan dengan substrat. Ada dua jenis inhibitor utama: kompetitif dan non-kompetitif.
Mekanisme Kerja Inhibitor Kompetitif dan Non-Kompetitif
- Inhibitor Kompetitif: Inhibitor ini bersaing dengan substrat untuk berikatan pada sisi aktif enzim. Semakin tinggi konsentrasi inhibitor kompetitif, semakin banyak enzim yang terhambat. Contohnya, malonat adalah inhibitor kompetitif untuk suksinat dehidrogenase, enzim yang berperan dalam siklus Krebs. Malonat memiliki struktur yang mirip dengan suksinat, sehingga dapat bersaing untuk berikatan pada sisi aktif enzim.
- Inhibitor Non-Kompetitif: Inhibitor ini berikatan pada sisi alosterik enzim (sisi selain sisi aktif), mengubah bentuk enzim sehingga afinitas enzim terhadap substrat menurun. Konsentrasi substrat tidak dapat mengatasi penghambatan ini. Contohnya, sianida adalah inhibitor non-kompetitif untuk sitokrom oksidase, enzim penting dalam respirasi seluler.
Ilustrasi Mekanisme Penghambatan
Bayangkan sisi aktif enzim sebagai kunci gembok. Substrat adalah kunci yang pas untuk membuka gembok (melakukan reaksi). Inhibitor kompetitif adalah kunci palsu yang bentuknya mirip dengan kunci asli, sehingga bersaing untuk masuk ke gembok. Sementara itu, inhibitor non-kompetitif seperti lem yang menempel di bagian lain gembok, mengubah bentuknya sehingga kunci asli tidak dapat masuk lagi.
| Faktor | Pengaruh terhadap Aktivitas Enzim | Penjelasan | Contoh |
|---|---|---|---|
| Suhu | Optimal pada suhu tertentu, menurun drastis pada suhu tinggi (denaturasi), menurun pada suhu rendah | Suhu mempengaruhi energi kinetik molekul, suhu tinggi menyebabkan denaturasi, suhu rendah mengurangi frekuensi tumbukan | Amilase pada suhu 37°C vs 50°C |
| pH | Optimal pada pH tertentu, menurun di luar rentang optimal | pH mempengaruhi muatan ionik pada gugus asam amino, mengganggu struktur enzim | Pepsin pada pH 2 vs pH 7 |
| Inhibitor Kompetitif | Mengurangi kecepatan reaksi dengan bersaing dengan substrat untuk sisi aktif | Inhibitor berikatan dengan sisi aktif, mencegah substrat berikatan | Malonat pada suksinat dehidrogenase |
| Inhibitor Non-Kompetitif | Mengurangi kecepatan reaksi dengan berikatan pada sisi alosterik | Inhibitor mengubah konformasi enzim, mengurangi afinitas terhadap substrat | Sianida pada sitokrom oksidase |
| Aktivator | Meningkatkan kecepatan reaksi | Aktivator dapat meningkatkan afinitas enzim terhadap substrat atau menstabilkan konformasi aktif enzim | Mg2+ pada heksokinase |
Kesimpulan
Singkatnya, konsentrasi enzim dan substrat merupakan dua pemain kunci dalam orkestra reaksi biokimia. Jumlah enzim menentukan kapasitas produksi, sementara jumlah substrat menentukan seberapa cepat pabrik tersebut dapat beroperasi. Memahami interaksi rumit antara keduanya, beserta faktor-faktor lain yang turut memengaruhi, memungkinkan kita untuk mengendalikan dan mengoptimalkan berbagai proses biologis dan industri. Dari ranah medis hingga industri makanan, pemahaman ini menjadi dasar inovasi dan efisiensi. Kesimpulannya, keseimbangan antara konsentrasi enzim dan substrat adalah kunci keberhasilan reaksi enzimatis yang optimal, layaknya resep rahasia sebuah hidangan yang sempurna.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya