Mengapa larutan non elektrolit tidak dapat menghantarkan arus listrik – Mengapa larutan non-elektrolit tidak dapat menghantarkan arus listrik? Pertanyaan ini mengantar kita pada dunia mikroskopis, di mana perilaku partikel menentukan sifat makroskopis suatu zat. Bayangkan arus listrik sebagai lautan elektron yang mengalir; dalam larutan elektrolit, ion-ion bermuatan bertindak sebagai perahu yang membawa muatan ini, menciptakan aliran yang lancar. Namun, dalam larutan non-elektrolit, “lautan” ini sunyi senyap, tak ada “perahu” yang membawa muatan. Ketiadaan partikel bermuatan inilah yang menyebabkan larutan non-elektrolit menjadi isolator listrik yang efektif. Memahami perbedaan ini penting, karena mempengaruhi beragam aplikasi, mulai dari baterai hingga industri makanan.
Larutan non-elektrolit, berbeda dengan saudaranya yang konduktif, larutan elektrolit, tidak memiliki kemampuan untuk menghantarkan arus listrik. Hal ini disebabkan oleh ketidakhadiran partikel bermuatan, yaitu ion, yang merupakan kunci dalam proses konduksi listrik dalam larutan. Zat terlarut dalam larutan non-elektrolit tidak terionisasi ketika dilarutkan dalam pelarut, sehingga tidak menghasilkan ion-ion bebas yang dapat bergerak dan membawa muatan listrik. Akibatnya, aliran listrik terhambat, dan larutan tersebut berperilaku sebagai isolator. Lebih lanjut, kita akan membahas secara detail mengapa hal ini terjadi dan implikasinya dalam berbagai aplikasi.
Larutan Elektrolit dan Non-Elektrolit: Mengapa yang Satu Menghantarkan Listrik, yang Lain Tidak?
Kemampuan suatu larutan untuk menghantarkan arus listrik merupakan sifat fisika yang penting, dan kunci pemahamannya terletak pada perbedaan mendasar antara larutan elektrolit dan non-elektrolit. Perbedaan ini berdampak luas, mulai dari aplikasi industri hingga proses biologis dalam tubuh kita. Mari kita telusuri lebih dalam perbedaan mendasar kedua jenis larutan ini.
Ketiadaan ion bebas dalam larutan non-elektrolit menjadi kunci mengapa mereka tak mampu menghantarkan arus listrik. Berbeda dengan garam yang terionisasi, molekul-molekul netral dalam larutan non-elektrolit tidak memiliki muatan untuk membawa arus. Bayangkan, urusan pengiriman paket Anda terhambat karena JNT ternyata tutup di hari Minggu—cek dulu informasinya di jnt buka hari minggu sebelum mengirim—sedangkan ion-ion dalam larutan elektrolit ibarat kurir yang gesit membawa muatan listrik.
Singkatnya, tanpa partikel bermuatan, aliran listrik pun terhenti, sama seperti paket Anda mungkin tertahan jika JNT tak beroperasi. Jadi, ketidakmampuan larutan non-elektrolit menghantarkan listrik kembali pada sifat molekulnya yang netral.
Perbedaan Larutan Elektrolit dan Non-Elektrolit
Perbedaan utama antara larutan elektrolit dan non-elektrolit terletak pada kemampuannya menghasilkan ion dalam larutan. Elektrolit, ketika dilarutkan dalam air, terurai menjadi ion-ion bermuatan (kation dan anion) yang dapat bergerak bebas dan menghantarkan arus listrik. Sebaliknya, non-elektrolit tidak terionisasi dalam larutan, sehingga tidak menghasilkan ion-ion yang mampu menghantarkan arus listrik. Ini merupakan perbedaan fundamental yang menentukan sifat konduktivitas listrik suatu larutan.
Contoh Larutan Elektrolit dan Non-Elektrolit
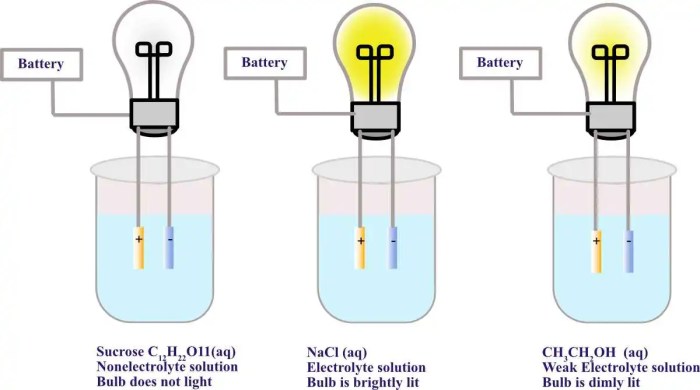
Memahami konsep ini menjadi lebih mudah dengan melihat contoh konkret. Garam dapur (NaCl), misalnya, merupakan elektrolit. Ketika dilarutkan dalam air, NaCl terionisasi menjadi ion Na+ dan Cl–. Sementara itu, gula (C12H22O11) merupakan contoh non-elektrolit. Ketika dilarutkan, gula tetap sebagai molekul utuh dan tidak terurai menjadi ion.
- Elektrolit: Natrium klorida (NaCl) → Na+ + Cl– ; Asam klorida (HCl) → H+ + Cl– ; Kalium hidroksida (KOH) → K+ + OH–
- Non-Elektrolit: Sukrosa (C12H22O11); Glukosa (C6H12O6); Etanol (C2H5OH)
Perbandingan Sifat Larutan Elektrolit dan Non-Elektrolit
Tabel berikut merangkum perbedaan sifat kunci antara larutan elektrolit dan non-elektrolit. Pemahaman perbedaan ini sangat krusial dalam berbagai aplikasi, dari baterai hingga sistem biologis.
| Sifat | Elektrolit | Non-Elektrolit |
|---|---|---|
| Daya Hantar Listrik | Menghantarkan arus listrik | Tidak menghantarkan arus listrik |
| Jenis Zat Terlarut | Senyawa ionik atau senyawa kovalen polar yang terionisasi | Senyawa kovalen nonpolar yang tidak terionisasi |
| Contoh | NaCl, HCl, NaOH | C12H22O11, C6H12O6, C2H5OH |
Faktor-Faktor yang Mempengaruhi Sifat Elektrolit dan Non-Elektrolit
Beberapa faktor berperan penting dalam menentukan apakah suatu larutan bersifat elektrolit atau non-elektrolit. Jenis ikatan kimia dalam zat terlarut, kepolaran molekul, dan kemampuan zat terlarut untuk terionisasi dalam pelarut merupakan faktor-faktor kunci yang perlu dipertimbangkan. Semakin kuat ikatan ionik atau semakin polar molekul, semakin besar kemungkinan larutan tersebut bersifat elektrolit.
Proses Ionisasi dan Daya Hantar Listrik
Proses ionisasi merupakan kunci pemahaman mengapa elektrolit dapat menghantarkan listrik. Ketika senyawa ionik atau senyawa kovalen polar terlarut dalam air, ikatan kimia terputus, dan ion-ion bermuatan positif dan negatif terbentuk. Ion-ion ini bebas bergerak dalam larutan, dan ketika medan listrik diterapkan, ion-ion ini bergerak menuju elektroda yang bermuatan berlawanan, sehingga menghasilkan aliran arus listrik. Semakin banyak ion yang dihasilkan, semakin tinggi daya hantar listrik larutan tersebut.
Mekanisme Penghantaran Arus Listrik dalam Larutan

Kemampuan suatu larutan untuk menghantarkan arus listrik bergantung pada keberadaan partikel bermuatan di dalamnya. Larutan elektrolit, berbeda dengan larutan non-elektrolit, mampu menghantarkan arus listrik karena adanya ion-ion yang bergerak bebas. Pemahaman mendalam tentang mekanisme ini krusial untuk berbagai aplikasi, mulai dari baterai hingga proses elektrokimia industri.
Penghantaran Arus Listrik dalam Larutan Elektrolit
Arus listrik dalam larutan elektrolit dihantarkan melalui pergerakan ion-ion bermuatan. Ketika elektrolit dilarutkan dalam pelarut, seperti air, senyawa tersebut terionisasi, melepaskan ion positif (kation) dan ion negatif (anion). Adanya medan listrik eksternal, misalnya dari baterai yang terhubung ke elektroda yang dicelupkan dalam larutan, menyebabkan ion-ion ini bergerak menuju elektroda dengan muatan berlawanan. Gerakan ion-ion inilah yang membentuk arus listrik.
Larutan non-elektrolit tak mampu menghantarkan listrik karena tak memiliki ion bebas yang dapat bergerak membawa muatan. Analogi sederhana: bayangkan arus listrik sebagai aliran anak sungai, ion-ion sebagai airnya. Tanpa air yang mengalir, tak ada arus. Begitu pula, pemahaman mendalam tentang ketaatan—seperti yang dibahas dalam artikel mengapa kita harus patuh kepada orang tua —membutuhkan proses berpikir yang jernih, layaknya memahami konsep dasar kelistrikan.
Sama seperti kepatuhan yang membutuhkan pemahaman akan hikmah di baliknya, penghantaran listrik memerlukan adanya partikel bermuatan yang bergerak bebas. Jadi, tanpa ion bebas, larutan non-elektrolit tetap menjadi isolator listrik yang efektif.
Proses Ionisasi dalam Larutan Elektrolit
Bayangkan sebuah larutan garam dapur (NaCl) dalam air. Molekul NaCl yang bersifat ionik akan terdisosiasi menjadi ion Na+ dan ion Cl–. Ion Na+, bermuatan positif, akan tertarik ke elektroda negatif (katoda), sementara ion Cl–, bermuatan negatif, akan tertarik ke elektroda positif (anoda). Proses ini menghasilkan suatu aliran muatan listrik yang dapat diukur sebagai arus listrik. Visualisasikan hal ini sebagai lautan kecil partikel-partikel bermuatan yang bergerak secara teratur di bawah pengaruh medan listrik. Partikel-partikel ini, dalam jumlah besar, menghasilkan arus yang signifikan.
Perbandingan Penghantaran Arus Listrik dalam Larutan Elektrolit dan Logam, Mengapa larutan non elektrolit tidak dapat menghantarkan arus listrik
Penghantaran arus listrik dalam larutan elektrolit berbeda dengan penghantaran dalam logam. Dalam logam, arus dihantarkan oleh elektron bebas yang bergerak melalui kisi kristal logam. Sedangkan dalam larutan elektrolit, arus dihantarkan oleh pergerakan ion-ion. Proses ini melibatkan perpindahan muatan melalui ion-ion yang bergerak, bukan elektron bebas seperti pada logam. Kecepatan pergerakan ion juga lebih lambat dibandingkan pergerakan elektron dalam logam, sehingga konduktivitas larutan elektrolit umumnya lebih rendah daripada konduktivitas logam.
Diagram Alir Penghantaran Arus Listrik dalam Larutan Elektrolit
Berikut langkah-langkah penghantaran arus listrik dalam larutan elektrolit secara ringkas:
- Elektrolit dilarutkan dalam pelarut, menghasilkan ion-ion.
- Elektroda dicelupkan ke dalam larutan.
- Sumber tegangan dihubungkan ke elektroda, menciptakan medan listrik.
- Ion-ion bergerak menuju elektroda dengan muatan berlawanan.
- Pergerakan ion-ion membentuk arus listrik.
Peran Ion-ion dalam Penghantaran Arus Listrik
Ion-ion memegang peran sentral dalam penghantaran arus listrik dalam larutan elektrolit. Konsentrasi ion dan mobilitasnya menentukan besarnya konduktivitas larutan. Semakin tinggi konsentrasi ion dan semakin tinggi mobilitasnya, semakin besar kemampuan larutan untuk menghantarkan arus listrik. Jenis ion juga berpengaruh; ion dengan muatan lebih tinggi akan memberikan kontribusi yang lebih besar terhadap konduktivitas.
Ketidakmampuan larutan non-elektrolit menghantarkan listrik berakar pada absennya ion bebas dalam larutan tersebut. Berbeda dengan elektrolit yang terionisasi, menghasilkan partikel bermuatan yang memungkinkan aliran arus, non-elektrolit tetap dalam bentuk molekul netral. Ini mirip dengan bagaimana nabi yang disebut khatamul anbiya adalah Nabi Muhammad SAW, yang menjadi penutup rangkaian kenabian, menandai sebuah titik akhir.
Kembali ke larutan, tanpa muatan yang bergerak bebas, tidak ada konduksi listrik yang terjadi, menjelaskan mengapa larutan gula, misalnya, tidak dapat menyalakan lampu seperti larutan garam.
Mengapa Larutan Non-Elektrolit Tidak Menghantarkan Arus Listrik?: Mengapa Larutan Non Elektrolit Tidak Dapat Menghantarkan Arus Listrik
Larutan non-elektrolit, berbeda dengan saudara kembarnya, larutan elektrolit, memiliki karakteristik unik yang membatasi kemampuannya dalam menghantarkan arus listrik. Ketidakmampuan ini bukan sekadar fenomena kimiawi yang membosankan, melainkan kunci pemahaman mendasar tentang interaksi materi dan energi. Memahami perbedaan perilaku kedua jenis larutan ini penting dalam berbagai aplikasi, mulai dari baterai hingga sistem kelistrikan di tubuh manusia.
Komposisi Partikel dalam Larutan Elektrolit dan Non-Elektrolit
Perbedaan mendasar terletak pada komposisi partikel penyusunnya. Larutan elektrolit, seperti garam dapur (NaCl) yang dilarutkan dalam air, terdisosiasi menjadi ion-ion bermuatan, yaitu ion positif (kation) dan ion negatif (anion). Ion-ion ini bergerak bebas dalam larutan dan mampu membawa muatan listrik. Sebaliknya, larutan non-elektrolit, seperti larutan gula (sukrosa) dalam air, tidak terurai menjadi ion. Molekul gula tetap utuh dan netral, tidak memiliki muatan listrik untuk menghantarkan arus. Perbedaan ini membentuk dasar perbedaan kemampuan menghantarkan listrik. Bayangkan seperti ini: ion-ion dalam larutan elektrolit seperti mobil-mobil kecil yang membawa muatan listrik, sedangkan molekul netral dalam larutan non-elektrolit seperti mobil yang tidak memiliki mesin, tak mampu bergerak membawa muatan.
Perilaku Partikel saat Dialiri Arus Listrik
Ketika arus listrik dialirkan ke dalam larutan elektrolit, ion-ion bermuatan akan bergerak menuju elektroda dengan muatan berlawanan. Kation bergerak menuju katoda (elektroda negatif), sementara anion bergerak menuju anoda (elektroda positif). Pergerakan ion-ion ini membentuk arus listrik. Sebaliknya, dalam larutan non-elektrolit, molekul netral tidak terpengaruh oleh medan listrik. Mereka tetap acak dan tidak terarah, sehingga tidak ada aliran muatan listrik yang signifikan. Analogi sederhana: larutan elektrolit seperti jalan raya yang ramai dengan kendaraan bermuatan, sedangkan larutan non-elektrolit seperti jalanan sepi yang tidak ada aktivitas perpindahan muatan.
Ilustrasi Pergerakan Partikel
Bayangkan sebuah wadah berisi larutan. Pada larutan elektrolit, kita melihat ion-ion positif dan negatif bergerak secara teratur menuju elektroda yang bermuatan berlawanan ketika medan listrik diterapkan. Mereka membentuk jalur-jalur aliran yang terarah. Berbeda dengan larutan non-elektrolit, molekul-molekulnya bergerak secara acak dan tidak terpengaruh oleh medan listrik eksternal. Tidak ada pola pergerakan yang terarah, sehingga tidak ada aliran muatan yang signifikan. Gambaran ini menggambarkan perbedaan mendasar dalam mobilitas partikel dan kemampuan menghantarkan listrik.
Implikasi Tidak Adanya Ion Bebas
Ketiadaan ion bebas dalam larutan non-elektrolit secara langsung berimplikasi pada daya hantar listriknya yang rendah atau bahkan nol. Karena tidak ada pembawa muatan yang bergerak bebas, arus listrik tidak dapat mengalir dengan efektif. Ini berbeda dengan larutan elektrolit, di mana ion-ion bebas bertindak sebagai konduktor yang efisien, memungkinkan aliran arus listrik yang signifikan. Hal ini memiliki konsekuensi praktis yang luas, terutama dalam aplikasi teknologi yang memanfaatkan sifat konduktivitas listrik. Misalnya, larutan elektrolit digunakan dalam baterai untuk memfasilitasi aliran elektron, sedangkan larutan non-elektrolit tidak cocok untuk aplikasi tersebut.
Contoh Penerapan Konsep Larutan Elektrolit dan Non-Elektrolit
Pemahaman tentang larutan elektrolit dan non-elektrolit bukan sekadar teori kimia di buku pelajaran. Konsep ini punya aplikasi luas dan dampak signifikan dalam kehidupan sehari-hari, dari baterai yang menghidupi gadget kita hingga minuman isotonik yang kita konsumsi setelah berolahraga. Memahami perbedaan keduanya penting untuk mengoptimalkan penggunaan dan meminimalisir risiko yang mungkin timbul.
Penerapan Larutan Elektrolit dalam Kehidupan Sehari-hari
Larutan elektrolit, yang mampu menghantarkan arus listrik karena adanya ion-ion di dalamnya, memiliki peran krusial dalam berbagai aspek kehidupan modern. Kemampuannya untuk menghantarkan listrik dimanfaatkan dalam berbagai teknologi dan proses industri. Berikut beberapa contohnya:
- Baterai: Baterai mobil, baterai ponsel, hingga baterai jam tangan, semuanya bergantung pada reaksi elektrolit untuk menghasilkan arus listrik. Elektrolit dalam baterai berperan sebagai media bagi pergerakan ion, memungkinkan terjadinya reaksi redoks yang menghasilkan energi listrik.
- Penghantar Listrik: Beberapa larutan elektrolit, seperti larutan garam, digunakan dalam proses elektroplating, yaitu pelapisan logam dengan logam lain untuk meningkatkan daya tahan atau estetika. Proses ini memanfaatkan kemampuan larutan elektrolit untuk menghantarkan arus listrik.
- Minuman Isotonik: Minuman ini mengandung elektrolit seperti natrium dan kalium yang membantu mengganti cairan dan elektrolit yang hilang selama aktivitas fisik berat. Elektrolit ini penting untuk menjaga keseimbangan cairan tubuh dan fungsi otot.
- Cairan Infus: Di bidang kesehatan, larutan elektrolit dalam bentuk cairan infus digunakan untuk mengganti cairan dan elektrolit yang hilang akibat dehidrasi atau penyakit tertentu. Komposisi elektrolit dalam cairan infus disesuaikan dengan kebutuhan pasien.
Penerapan Larutan Non-Elektrolit dalam Kehidupan Sehari-hari
Berbeda dengan elektrolit, larutan non-elektrolit tidak mampu menghantarkan arus listrik karena tidak terionisasi dalam air. Meskipun tidak menghantarkan listrik, larutan ini memiliki peran penting dalam berbagai aplikasi, khususnya dalam industri makanan dan minuman.
- Minuman Manis: Minuman seperti sirup dan jus buah pada umumnya merupakan larutan non-elektrolit. Gula yang terlarut dalam air tidak terionisasi, sehingga tidak menghantarkan listrik.
- Larutan Gula: Larutan gula digunakan dalam berbagai proses industri makanan, seperti pembuatan manisan dan pengawetan makanan. Sifatnya yang tidak menghantarkan listrik membuatnya aman digunakan dalam berbagai aplikasi.
- Etanol (Alkohol): Etanol, komponen utama minuman beralkohol, merupakan larutan non-elektrolit. Penggunaannya dalam minuman tentunya perlu dikontrol dan dikonsumsi secara bertanggung jawab.
Perbandingan Larutan Elektrolit dan Non-Elektrolit
Berikut tabel perbandingan beberapa contoh larutan elektrolit dan non-elektrolit beserta kegunaannya:
| Jenis Larutan | Contoh | Kegunaan | Konduktivitas Listrik |
|---|---|---|---|
| Elektrolit | Air Garam | Elektroplating, pengawetan makanan | Tinggi |
| Elektrolit | Asam Baterai | Sumber energi dalam baterai | Tinggi |
| Non-Elektrolit | Gula dalam air | Pemanis, pengawet makanan | Rendah |
| Non-Elektrolit | Etanol | Bahan baku minuman, pelarut | Rendah |
Dampak Penggunaan Larutan Elektrolit dan Non-Elektrolit
Perbedaan sifat konduktivitas listrik antara larutan elektrolit dan non-elektrolit berdampak signifikan pada berbagai aplikasi. Penggunaan larutan elektrolit yang tepat krusial dalam teknologi yang bergantung pada aliran listrik, sementara penggunaan larutan non-elektrolit lebih difokuskan pada sifat kimia dan fisiknya, seperti rasa, kekentalan, dan daya larut.
Misalnya, kesalahan dalam pemilihan elektrolit pada baterai dapat mengakibatkan kerusakan baterai atau bahkan bahaya kebakaran. Sebaliknya, penggunaan larutan non-elektrolit yang tidak tepat dalam makanan dapat mempengaruhi rasa dan kualitas produk.
Perbedaan Larutan Elektrolit dan Non-Elektrolit
Pemahaman yang komprehensif tentang perbedaan mendasar antara larutan elektrolit dan non-elektrolit mencakup kemampuan menghantarkan listrik, mekanisme ionisasi dalam larutan, dan dampaknya pada berbagai aplikasi. Perbedaan ini menjadi dasar dalam pemilihan bahan dan desain berbagai produk dan proses industri.
Kesimpulan
Singkatnya, kemampuan suatu larutan untuk menghantarkan arus listrik bergantung pada keberadaan ion-ion bermuatan bebas. Larutan non-elektrolit, yang terdiri dari molekul netral yang tidak terionisasi, tidak memiliki ion-ion tersebut. Oleh karena itu, mereka tidak dapat menghantarkan arus listrik. Pemahaman mendalam tentang perbedaan ini memiliki implikasi yang luas dalam berbagai bidang, dari pengembangan baterai yang efisien hingga pemahaman proses biologis dalam tubuh manusia. Mempelajari larutan elektrolit dan non-elektrolit bukan hanya tentang teori, tetapi juga tentang aplikasi praktis yang menentukan kemajuan teknologi dan kesejahteraan kita.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya