Mengapa senyawa kovalen juga merupakan larutan elektrolit? Pertanyaan ini mungkin terdengar paradoksal, mengingat senyawa kovalen dikenal karena ikatannya yang non-ionik. Namun, kenyataannya beberapa senyawa kovalen, khususnya asam dan basa kuat, mampu menghantarkan listrik dalam larutan. Fenomena ini membuka jendela pemahaman lebih dalam tentang perilaku molekul dan interaksi antarmolekul dalam media cair. Kemampuan menghantarkan listrik ini tergantung pada beberapa faktor kunci, termasuk kepolaran molekul dan kekuatan ikatan kovalen. Lebih lanjut, pemahaman mendalam tentang ionisasi senyawa kovalen crucial dalam berbagai aplikasi, mulai dari baterai hingga reaksi kimia di industri.
Senyawa kovalen, yang terbentuk dari pemakaian bersama elektron antar atom, umumnya tidak menghantarkan listrik dalam bentuk murni. Berbeda dengan senyawa ionik yang terdisosiasi menjadi ion-ion bermuatan ketika dilarutkan, senyawa kovalen cenderung tetap dalam bentuk molekul netral. Namun, sejumlah senyawa kovalen, terutama asam dan basa kuat, mengalami ionisasi dalam air, menghasilkan ion-ion yang mampu menghantarkan arus listrik. Proses ionisasi ini dipengaruhi oleh kepolaran ikatan kovalen dan kekuatan ikatan tersebut. Semakin polar ikatan dan semakin lemah ikatan kovalen, semakin mudah senyawa tersebut terionisasi dan menghantarkan listrik.
Senyawa Kovalen dan Elektrolit: Lebih dari Sekadar Ikatan Kimia
Mungkin kita sering mendengar istilah senyawa kovalen dan elektrolit dalam pelajaran kimia. Namun, pemahaman yang lebih dalam diperlukan untuk mengapresiasi kompleksitas interaksi antarmolekul dan bagaimana hal ini memengaruhi sifat-sifat suatu zat, termasuk kemampuannya menghantarkan listrik. Artikel ini akan mengupas tuntas mengenai senyawa kovalen dan elektrolit, termasuk membahas fenomena unik di mana senyawa kovalen tertentu dapat bertindak sebagai elektrolit. Ini bukan sekadar tentang ikatan kimia; ini tentang bagaimana struktur molekul berdampak pada sifat makroskopis suatu zat.
Definisi Senyawa Kovalen dan Contohnya
Senyawa kovalen terbentuk melalui pemakaian bersama pasangan elektron antara dua atom non-logam. Ikatan ini relatif kuat, tetapi daya tarik antarmolekulnya bervariasi, tergantung pada polaritas molekul. Air (H₂O), misalnya, merupakan senyawa kovalen polar karena perbedaan elektronegativitas antara atom hidrogen dan oksigen. Sementara itu, metana (CH₄) adalah contoh senyawa kovalen nonpolar karena atom karbon dan hidrogen memiliki elektronegativitas yang hampir sama. Contoh lain senyawa kovalen meliputi karbondioksida (CO₂), amonia (NH₃), dan glukosa (C₆H₁₂O₆). Keberagaman senyawa kovalen ini mencerminkan keragaman sifat dan perannya dalam kehidupan sehari-hari.
Definisi Larutan Elektrolit dan Contohnya
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena adanya ion-ion bermuatan dalam larutan tersebut. Kemampuan menghantarkan listrik ini disebabkan oleh mobilitas ion-ion yang bebas bergerak dan membawa muatan listrik. Garam dapur (NaCl) yang terlarut dalam air merupakan contoh klasik larutan elektrolit. Ketika NaCl terlarut, ia terdisosiasi menjadi ion Na⁺ dan Cl⁻ yang bebas bergerak dalam larutan, sehingga mampu menghantarkan arus listrik. Asam kuat seperti asam klorida (HCl) dan basa kuat seperti natrium hidroksida (NaOH) juga merupakan elektrolit kuat karena terionisasi sempurna dalam larutan. Sebaliknya, asam lemah dan basa lemah hanya terionisasi sebagian, sehingga menjadi elektrolit lemah.
Perbandingan Konduktivitas Listrik Senyawa Kovalen dan Elektrolit
Perbedaan mendasar antara senyawa kovalen dan elektrolit terletak pada kemampuannya menghantarkan arus listrik. Elektrolit, dengan ion-ion bebasnya, merupakan konduktor listrik yang baik, baik dalam bentuk cair maupun larutan. Sebaliknya, sebagian besar senyawa kovalen murni bersifat isolator listrik karena tidak memiliki ion-ion bebas untuk membawa muatan. Namun, perlu diingat bahwa beberapa senyawa kovalen polar dapat terionisasi sebagian dalam larutan dan menunjukkan konduktivitas listrik yang rendah, menunjukkan sifat elektrolit lemah.
Senyawa kovalen, meski umumnya non-elektrolit, bisa menjadi larutan elektrolit jika mengalami ionisasi atau disosiasi dalam pelarut tertentu. Proses ini menghasilkan ion-ion bermuatan yang mampu menghantarkan arus listrik. Memahami konsep ini penting, misalnya bagi siswa SMK yang bercita-cita melanjutkan pendidikan tinggi di bidang kimia. Informasi mengenai pilihan universitas yang tepat bisa didapatkan di universitas yang menerima lulusan SMK , sebuah langkah strategis untuk mengasah pemahaman lebih lanjut tentang elektrolit dan senyawa kovalen.
Dengan demikian, kemampuan menghantarkan arus listrik pada larutan senyawa kovalen tertentu menjadi fenomena menarik yang patut dikaji lebih dalam.
Tabel Perbandingan Sifat Fisika dan Kimia
| Sifat | Senyawa Kovalen | Elektrolit |
|---|---|---|
| Titik leleh dan didih | Relatif rendah | Relatif tinggi |
| Konduktivitas listrik | Rendah (kecuali dalam larutan tertentu) | Tinggi (dalam bentuk cair atau larutan) |
| Ikatan kimia | Kovalen (pemakaian bersama elektron) | Ionik (transfer elektron) |
Contoh Senyawa Kovalen Polar dan Nonpolar
Perbedaan elektronegativitas atom-atom penyusun menentukan polaritas molekul kovalen. Air (H₂O), dengan perbedaan elektronegativitas yang signifikan antara oksigen dan hidrogen, memiliki distribusi muatan yang tidak merata, sehingga bersifat polar. Ini menyebabkan adanya dipol permanen dan gaya tarik-menarik antarmolekul yang lebih kuat dibandingkan senyawa nonpolar. Sebaliknya, metana (CH₄) memiliki perbedaan elektronegativitas yang kecil antara karbon dan hidrogen, sehingga distribusi muatannya relatif merata dan bersifat nonpolar. Gaya antarmolekul pada metana lebih lemah dibandingkan air, yang tercermin dalam titik didihnya yang jauh lebih rendah.
Beberapa senyawa kovalen, meski umumnya non-elektrolit, bisa menjadi larutan elektrolit karena terionisasi dalam air. Ini terjadi akibat reaksi dengan air, membentuk ion-ion yang menghantarkan listrik. Analogi sederhana, seperti halnya dalam menyanyikan lagu harus sesuai dengan nada dan irama, ionisasi senyawa kovalen tertentu harus memenuhi kondisi tertentu agar dapat menghantarkan arus listrik. Proses ini mengubah sifat larutan, sehingga kemampuan menghantarkan listrik pun berubah.
Jadi, kemampuan senyawa kovalen menjadi elektrolit bergantung pada kemampuannya bereaksi dan terionisasi dalam pelarut, bukan semata-mata pada ikatan kovalennya sendiri.
Senyawa Kovalen yang Merupakan Elektrolit
Umumnya, senyawa kovalen dikenal sebagai non-elektrolit, artinya tidak dapat menghantarkan arus listrik dalam larutan. Namun, ada pengecualian penting: asam dan basa kuat. Mereka, meskipun terbentuk dari ikatan kovalen, mampu terionisasi sempurna dalam air, menghasilkan ion-ion yang dapat membawa muatan listrik. Fenomena ini menantang pemahaman sederhana tentang senyawa kovalen dan mengungkap kedalaman interaksi molekul dalam larutan. Memahami perilaku ini krusial, terutama dalam konteks reaksi kimia dan aplikasi praktisnya, mulai dari baterai hingga proses industri.
Senyawa Kovalen Elektrolit: Asam dan Basa Kuat
Asam dan basa kuat, meskipun terbentuk dari ikatan kovalen, berbeda dengan senyawa kovalen pada umumnya karena kemampuannya terionisasi sempurna dalam air. Ionisasi ini menghasilkan ion-ion bermuatan yang mampu menghantarkan arus listrik. Proses ini merupakan kunci pemahaman mengapa beberapa senyawa kovalen tergolong elektrolit.
Ionisasi Asam dan Basa Kuat dalam Air
Asam kuat, ketika dilarutkan dalam air, akan melepaskan proton (ion H+) secara sempurna. Sebaliknya, basa kuat melepaskan ion hidroksida (OH-) secara sempurna. Proses ini menghasilkan konsentrasi ion yang tinggi dalam larutan, sehingga larutan tersebut dapat menghantarkan arus listrik dengan efisien. Perbedaan ini signifikan dibandingkan dengan asam dan basa lemah yang hanya terionisasi sebagian.
Contoh Asam dan Basa Kuat serta Reaksi Ionisasinya, Mengapa senyawa kovalen juga merupakan larutan elektrolit
Sebagai ilustrasi, asam klorida (HCl) dan natrium hidroksida (NaOH) merupakan contoh klasik asam dan basa kuat. HCl terionisasi sempurna menjadi ion H+ dan Cl-, sementara NaOH terionisasi sempurna menjadi ion Na+ dan OH-. Reaksi ionisasinya dapat digambarkan sebagai berikut:
- HCl(aq) → H+(aq) + Cl-(aq)
- NaOH(aq) → Na+(aq) + OH-(aq)
Reaksi-reaksi ini menunjukkan pelepasan ion secara lengkap, menghasilkan larutan yang mampu menghantarkan listrik dengan baik. Kemampuan menghantarkan listrik ini sebanding dengan derajat ionisasi, semakin sempurna ionisasi, semakin baik daya hantar listriknya.
Senyawa kovalen, meski umumnya tak menghantarkan listrik, bisa menjadi larutan elektrolit jika terionisasi dalam pelarut tertentu. Ini berbeda dengan daya tarik estetika ragam hias flora, yang penjelasannya bisa Anda temukan di mengapa ragam hias flora banyak disukai masyarakat , sebuah fenomena yang sama menariknya dengan perilaku kimiawi. Kembali ke senyawa kovalen, ionisasi ini menghasilkan ion-ion bermuatan yang mampu menghantarkan arus listrik, sehingga mengubah sifat konduktivitasnya.
Intinya, kemampuan menghantarkan listrik bukan semata sifat intrinsik, melainkan juga bergantung pada kondisi lingkungan dan interaksi antarmolekul.
Poin-Poin Penting Ionisasi Asam dan Basa Kuat
- Asam dan basa kuat terionisasi sempurna dalam air.
- Proses ionisasi menghasilkan konsentrasi ion yang tinggi.
- Larutan asam dan basa kuat merupakan konduktor listrik yang baik.
- Derajat ionisasi asam dan basa kuat mendekati 100%.
- Contoh asam kuat: HCl, HBr, HI, HNO3, H2SO4 (ionisasi tahap pertama).
- Contoh basa kuat: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Perbedaan Asam Lemah dan Asam Kuat dalam Menghantarkan Listrik
Asam kuat terionisasi sempurna dalam air, menghasilkan konsentrasi ion H+ yang tinggi, sehingga larutannya merupakan konduktor listrik yang baik. Sebaliknya, asam lemah hanya terionisasi sebagian, menghasilkan konsentrasi ion H+ yang rendah, sehingga larutannya merupakan konduktor listrik yang buruk. Perbedaan ini mencerminkan perbedaan kekuatan ikatan kovalen dalam molekul asam dan interaksi dengan molekul air. Semakin kuat asam, semakin mudah melepaskan ion H+ dan semakin baik kemampuannya menghantarkan listrik.
Mekanisme Ionisasi Senyawa Kovalen
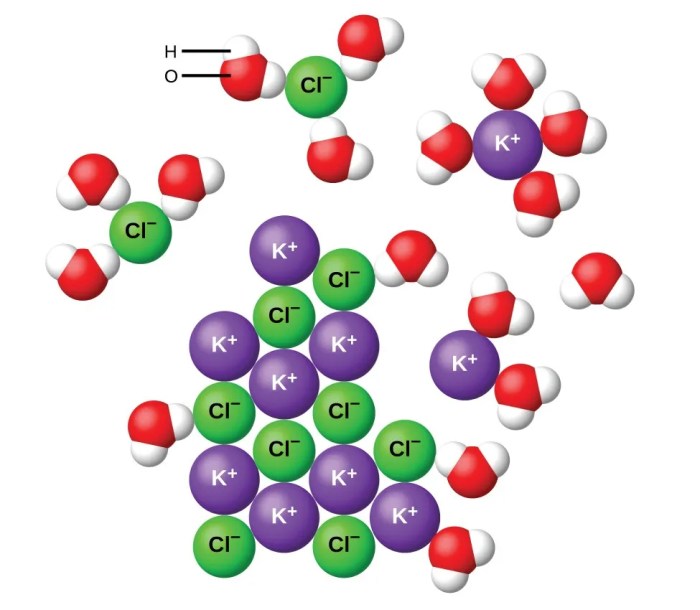
Senyawa kovalen, yang terbentuk dari pemakaian bersama elektron antar atom, umumnya dikenal sebagai non-elektrolit. Namun, kenyataannya beberapa senyawa kovalen tertentu dapat terionisasi dalam larutan, membentuk ion dan menghantarkan arus listrik. Fenomena ini menantang pemahaman sederhana kita tentang ikatan kovalen dan membuka jendela baru dalam pemahaman perilaku senyawa kimia dalam berbagai kondisi. Memahami mekanisme ionisasi ini krusial, khususnya dalam konteks aplikasi di berbagai bidang, mulai dari industri hingga biologi.
Ionisasi senyawa kovalen merupakan proses kompleks yang dipengaruhi oleh beberapa faktor kunci. Bukan sekadar pemutusan ikatan, melainkan melibatkan interaksi antara molekul kovalen dengan pelarut, khususnya air, yang berperan sebagai medium reaksi. Kemampuan senyawa kovalen untuk terionisasi erat kaitannya dengan kepolaran ikatan, kekuatan ikatan kovalen, dan interaksi antarmolekul. Dengan memahami faktor-faktor ini, kita dapat memprediksi dan menjelaskan perilaku elektrolit dari senyawa kovalen tertentu.
Peran Kepolaran Ikatan dalam Ionisasi
Kepolaran ikatan, yang mencerminkan perbedaan elektronegativitas antar atom yang berikatan, memainkan peran penting dalam ionisasi senyawa kovalen. Senyawa kovalen polar, dengan distribusi elektron yang tidak merata, cenderung lebih mudah terionisasi dibandingkan senyawa kovalen nonpolar. Hal ini karena adanya dipol permanen pada molekul polar yang memungkinkan interaksi yang kuat dengan molekul pelarut polar seperti air. Interaksi ini dapat melemahkan ikatan kovalen dan memudahkan pembentukan ion. Sebagai contoh, asam klorida (HCl) yang merupakan senyawa kovalen polar, mudah terionisasi dalam air membentuk ion H+ dan Cl–. Sebaliknya, senyawa kovalen nonpolar seperti metana (CH4) memiliki sedikit kecenderungan untuk terionisasi dalam air.
Pengaruh Kekuatan Ikatan Kovalen terhadap Kemampuan Terionisasi
Kekuatan ikatan kovalen juga mempengaruhi kemampuan senyawa kovalen untuk terionisasi. Ikatan kovalen yang lemah lebih mudah diputus dibandingkan ikatan kovalen yang kuat. Oleh karena itu, senyawa kovalen dengan ikatan kovalen lemah cenderung lebih mudah terionisasi. Namun, perlu diingat bahwa kekuatan ikatan hanyalah salah satu faktor yang perlu dipertimbangkan. Kepolaran ikatan dan interaksi dengan pelarut juga berperan penting.
Contoh Reaksi Ionisasi Senyawa Kovalen Polar dalam Air
Salah satu contoh reaksi ionisasi senyawa kovalen polar dalam air adalah ionisasi asam klorida (HCl). Dalam air, molekul HCl berinteraksi dengan molekul air melalui ikatan hidrogen. Interaksi ini menyebabkan pelemahan ikatan kovalen antara atom H dan Cl. Akibatnya, ikatan kovalen terputus, dan terbentuk ion H+ (ion hidronium, H3O+ dalam larutan air) dan Cl–. Reaksi dapat dituliskan sebagai berikut:
HCl(g) + H2O(l) → H3O+(aq) + Cl–(aq)
Reaksi ini menunjukkan bagaimana senyawa kovalen polar dapat terionisasi dalam air, membentuk larutan elektrolit yang mampu menghantarkan arus listrik.
Ilustrasi Disosiasi Ion dalam Larutan Elektrolit
Bayangkan sebuah ilustrasi sederhana: molekul HCl yang polar, dengan atom klorida yang lebih elektronegatif, ditunjukkan dengan muatan parsial negatif (δ-) dan atom hidrogen dengan muatan parsial positif (δ+). Ketika HCl dilarutkan dalam air, molekul air yang polar (dengan oksigen yang bermuatan parsial negatif dan hidrogen yang bermuatan parsial positif) mengelilingi molekul HCl. Molekul air yang bermuatan parsial negatif tertarik pada atom hidrogen HCl yang bermuatan parsial positif, sementara molekul air yang bermuatan parsial positif tertarik pada atom klorida HCl yang bermuatan parsial negatif. Interaksi ini melemahkan ikatan kovalen antara H dan Cl, akhirnya menyebabkan pemisahan menjadi ion H+ dan Cl– yang terhidrasi (dikelilingi oleh molekul air). Proses ini menghasilkan larutan yang mampu menghantarkan arus listrik karena adanya ion-ion bebas bergerak.
Faktor-faktor yang Mempengaruhi Konduktivitas Listrik

Senyawa kovalen, yang umumnya dikenal sebagai penghantar listrik yang buruk, ternyata dapat menunjukkan sifat elektrolit dalam kondisi tertentu. Kemampuannya menghantarkan arus listrik dalam bentuk larutan dipengaruhi oleh beberapa faktor kunci. Pemahaman mendalam mengenai faktor-faktor ini penting untuk mengoptimalkan penggunaan senyawa kovalen dalam berbagai aplikasi, mulai dari baterai hingga sensor kimia. Berikut uraian lebih lanjut mengenai faktor-faktor tersebut.
Pengaruh Konsentrasi Larutan terhadap Konduktivitas
Konsentrasi larutan berperan krusial dalam menentukan kemampuan senyawa kovalen untuk menghantarkan listrik. Semakin tinggi konsentrasi larutan, semakin banyak ion yang terdisosiasi dan tersedia untuk membawa muatan listrik. Ini berarti semakin besar pula konduktivitasnya. Bayangkan sebuah jalan raya: semakin banyak kendaraan (ion) yang melintas, semakin padat lalu lintas (arus listrik) yang terjadi. Sebaliknya, larutan dengan konsentrasi rendah memiliki sedikit ion, sehingga konduktivitasnya pun rendah. Perlu dicatat bahwa kemampuan disosiasi senyawa kovalen itu sendiri juga mempengaruhi hubungan konsentrasi dan konduktivitas. Tidak semua senyawa kovalen terionisasi sempurna dalam larutan.
Senyawa Kovalen yang Juga Merupakan Elektrolit
Kemampuan suatu zat untuk menghantarkan arus listrik dalam larutannya ditentukan oleh keberadaan ion-ion bermuatan. Senyawa ionik, dengan ikatan elektrostatis antar ion, secara umum merupakan konduktor listrik yang baik. Namun, fakta menariknya, beberapa senyawa kovalen juga menunjukkan sifat elektrolit, mampu menghantarkan arus listrik. Fenomena ini terjadi karena senyawa kovalen tertentu dapat terionisasi dalam larutan, menghasilkan ion-ion yang bergerak bebas dan membawa muatan listrik. Pemahaman tentang senyawa kovalen elektrolit penting dalam berbagai aplikasi, mulai dari baterai hingga proses industri.
Sifat elektrolit pada senyawa kovalen bergantung pada kemampuan senyawa tersebut untuk bereaksi dengan pelarut, seperti air, dan menghasilkan ion. Reaksi ini dapat berupa reaksi ionisasi atau reaksi hidrolisis, yang menghasilkan ion-ion bermuatan positif (kation) dan ion-ion bermuatan negatif (anion). Kemampuan menghantarkan listrik berbanding lurus dengan konsentrasi ion yang terbentuk dalam larutan. Semakin banyak ion yang dihasilkan, semakin kuat daya hantar listriknya.
Contoh Senyawa Kovalen Elektrolit Kuat dan Lemah
Beberapa senyawa kovalen, meskipun memiliki ikatan kovalen, mampu terionisasi sempurna atau sebagian dalam larutan, sehingga menghasilkan larutan yang dapat menghantarkan arus listrik. Perbedaan kemampuan ionisasi ini membagi senyawa kovalen elektrolit menjadi elektrolit kuat dan elektrolit lemah. Elektrolit kuat terionisasi sempurna, sementara elektrolit lemah hanya terionisasi sebagian.
- Asam Klorida (HCl): Rumus kimia HCl. Merupakan elektrolit kuat. Dalam air, HCl terionisasi sempurna menjadi ion H+ dan Cl–, menghasilkan daya hantar listrik yang tinggi. Sifat: asam kuat.
- Asam Sulfat (H₂SO₄): Rumus kimia H₂SO₄. Elektrolit kuat. Terionisasi sempurna dalam air menghasilkan ion H+ dan SO₄2-. Sifat: asam kuat.
- Asam Asetat (CH₃COOH): Rumus kimia CH₃COOH. Merupakan elektrolit lemah. Hanya sebagian kecil molekul CH₃COOH yang terionisasi dalam air menjadi ion H+ dan CH₃COO–, sehingga daya hantar listriknya relatif rendah. Sifat: asam lemah.
- Amonia (NH₃): Rumus kimia NH₃. Merupakan elektrolit lemah. Dalam air, amonia bereaksi dengan air (hidrolisis) membentuk ion amonium (NH₄+) dan ion hidroksida (OH–). Sifat: basa lemah.
Mengapa Senyawa Kovalen Tertentu Dapat Menghantarkan Listrik
Kemampuan senyawa kovalen untuk menghantarkan listrik bergantung pada polaritas ikatan dan kemampuannya berinteraksi dengan pelarut. Senyawa kovalen polar, seperti HCl dan H₂SO₄, memiliki perbedaan elektronegativitas yang signifikan antara atom-atom penyusunnya, sehingga menghasilkan muatan parsial positif dan negatif pada molekul. Interaksi dengan pelarut polar seperti air dapat memisahkan muatan parsial ini, menghasilkan ion-ion yang bebas bergerak dan menghantarkan listrik. Senyawa kovalen nonpolar umumnya tidak menghantarkan listrik karena tidak menghasilkan ion dalam larutan.
Daftar Senyawa Kovalen Elektrolit dan Sifat Keasaman/Kebasaannya
| Senyawa | Rumus Kimia | Sifat |
|---|---|---|
| Asam Klorida | HCl | Asam Kuat |
| Asam Sulfat | H₂SO₄ | Asam Kuat |
| Asam Nitrat | HNO₃ | Asam Kuat |
| Asam Asetat | CH₃COOH | Asam Lemah |
| Amonia | NH₃ | Basa Lemah |
Aplikasi Senyawa Kovalen Elektrolit dalam Kehidupan Sehari-hari
Senyawa kovalen elektrolit memiliki peran penting dalam berbagai aspek kehidupan kita. Asam-asam kuat seperti HCl dan H₂SO₄ digunakan secara luas dalam industri, misalnya dalam produksi pupuk, bahan peledak, dan pembersih. Asam-asam lemah seperti asam asetat, selain digunakan dalam pembuatan cuka, juga berperan dalam berbagai proses industri makanan dan farmasi. Sementara amonia, sebagai basa lemah, banyak digunakan dalam pembuatan pupuk dan pembersih rumah tangga. Kemampuannya menghantarkan listrik juga dimanfaatkan dalam baterai dan sel elektrokimia lainnya.
Pemungkas: Mengapa Senyawa Kovalen Juga Merupakan Larutan Elektrolit
Singkatnya, kemampuan beberapa senyawa kovalen untuk menjadi elektrolit terletak pada kemampuannya untuk terionisasi dalam larutan. Proses ini tidak selalu terjadi; hanya senyawa kovalen tertentu, terutama asam dan basa kuat, yang menunjukkan sifat elektrolit. Kepolaran molekul dan kekuatan ikatan kovalen memainkan peran krusial dalam menentukan tingkat ionisasi dan konduktivitas listrik. Pemahaman mendalam tentang mekanisme ionisasi ini sangat penting untuk berbagai aplikasi praktis, menunjukkan betapa dinamis dan kompleksnya dunia kimia.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya