NH3 termasuk asam atau basa? Pertanyaan ini mungkin tampak sederhana, namun jawabannya membuka pintu menuju dunia kimia yang menarik. Amonia (NH3), senyawa nitrogen yang sederhana, memiliki peran krusial dalam berbagai industri dan proses alamiah. Sifat kimianya yang unik, khususnya kemampuannya berinteraksi dengan air, menentukan perannya sebagai basa lemah yang penting. Pemahaman mendalam tentang sifat basa NH3 sangat vital, mulai dari pembuatan pupuk hingga dampak lingkungannya yang perlu dipertimbangkan.
Amonia, dengan rumus kimia NH3, merupakan gas tak berwarna dengan bau menyengat yang khas. Sifat basanya berasal dari pasangan elektron bebas pada atom nitrogen yang dapat menerima proton (ion H+). Reaksi NH3 dengan air menghasilkan ion amonium (NH4+) dan ion hidroksida (OH-), yang menaikkan pH larutan, membuktikan sifat basanya. Kemampuannya membentuk ikatan hidrogen juga mempengaruhi titik didih dan kelarutannya dalam air. Sifat-sifat ini menjadi kunci pemahaman perannya dalam berbagai aplikasi, dari industri pertanian hingga manufaktur.
Sifat Kimia NH3
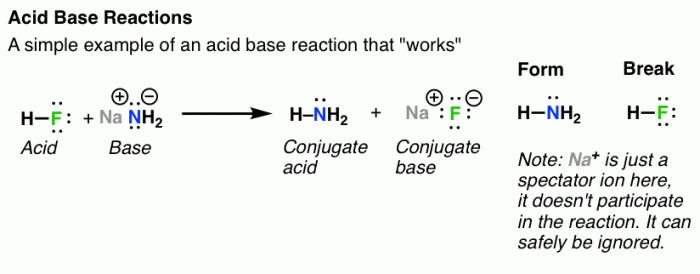
Amonia (NH3), senyawa kimia yang sederhana namun vital, memainkan peran penting dalam berbagai industri dan proses biologis. Pemahaman mendalam tentang sifat kimianya krusial, baik untuk pengembangan teknologi maupun pemahaman ekosistem. Dari sifat basa hingga kelarutannya yang unik, amonia menawarkan spektrum karakteristik yang menarik untuk dikaji.
Gugus Fungsi dan Pengaruhnya terhadap Sifat Kimia NH3
Amonia memiliki gugus fungsi amina (-NH2), yang menjadi kunci sifat basa amonia. Atom nitrogen dalam gugus ini memiliki pasangan elektron bebas yang dapat mendonorkan elektron kepada asam Brønsted-Lowry, membentuk ikatan kovalen koordinasi. Kemampuan mendonorkan elektron ini yang menyebabkan amonia bersifat basa. Reaksi ini menghasilkan ion amonium (NH4+), sebuah kation yang relatif stabil. Sifat basa ini menjadi dasar berbagai aplikasi amonia, dari pembuatan pupuk hingga sebagai penyangga pH dalam berbagai proses. Kekuatan basa amonia relatif lemah dibandingkan basa kuat seperti NaOH, tetapi cukup signifikan untuk mempengaruhi reaksi kimia.
Reaksi NH3 dengan Air
Amonia (NH3), senyawa kimia yang umum dijumpai, dikenal karena sifat basanya. Pemahaman mendalam tentang interaksi amonia dengan air sangat krusial, baik dalam konteks kimia dasar maupun aplikasi industri. Reaksi ini menunjukkan bagaimana amonia melepaskan ion dan mempengaruhi pH suatu larutan, membuka pintu untuk berbagai aplikasi, mulai dari pembuatan pupuk hingga proses industri lainnya.
Reaksi Amonia dengan Air
Amonia bereaksi dengan air melalui proses ionisasi. Molekul amonia, yang bersifat polar, berinteraksi dengan molekul air, yang juga polar. Atom hidrogen dalam air sedikit positif (δ+), sementara pasangan elektron bebas pada atom nitrogen dalam amonia bersifat sedikit negatif (δ-). Interaksi ini menyebabkan transfer proton (ion H+) dari molekul air ke molekul amonia. Persamaan reaksi seimbangnya adalah: NH₃(aq) + H₂O(l) ⇌ NH₄⁺(aq) + OH⁻(aq). Reaksi ini bersifat reversibel, artinya kesetimbangan tercapai antara reaktan dan produk.
Nilai pKb NH3
Amonia (NH3), senyawa kimia yang umum dijumpai, kerap kali menjadi subjek diskusi dalam kimia asam-basa. Memahami sifat basanya, khususnya melalui nilai pKb, krusial untuk berbagai aplikasi, mulai dari industri pupuk hingga pengolahan air. Nilai pKb mengindikasikan seberapa kuat amonia sebagai basa, memberikan gambaran kuantitatif tentang kemampuannya menerima proton (ion H+). Pemahaman ini penting untuk memprediksi perilaku amonia dalam berbagai reaksi dan kondisi.
Nilai pKb merupakan indikator kekuatan basa. Semakin kecil nilai pKb, semakin kuat basa tersebut. Ini berbanding terbalik dengan nilai pKa untuk asam, di mana nilai pKa yang lebih kecil menunjukkan asam yang lebih kuat. Perbedaan mendasar ini perlu dipahami untuk menganalisis reaksi kimia yang melibatkan asam dan basa.
Amonia (NH3), sejatinya bersifat basa, bereaksi dengan air membentuk ion hidroksida. Konsep ini mungkin terdengar asing bagi sebagian calon mahasiswa yang tengah mempertimbangkan pilihan jurusan, misalnya jurusan DKV di Bandung , yang menuntut kreativitas visual dan pemahaman mendalam akan warna dan komposisi. Namun, kembali ke NH3, sifat basanya ini sangat krusial dalam berbagai aplikasi industri, menunjukkan betapa ilmu kimia dasar, seperti memahami sifat asam-basa, merupakan pondasi penting dalam berbagai bidang.
Sifat basa NH3 ini terlihat jelas dari konstanta disosiasinya.
Nilai pKb Amonia
Nilai pKb amonia (NH3) pada suhu 25°C umumnya diterima sekitar 4,75. Data ini dapat diverifikasi dari berbagai sumber referensi kimia, termasuk buku teks kimia tingkat lanjut dan database kimia online yang terpercaya. Perbedaan kecil dalam nilai pKb mungkin muncul tergantung pada metode pengukuran dan kondisi eksperimen.
Hubungan pKb dan Kekuatan Basa NH3
Nilai pKb sebesar 4,75 menunjukkan bahwa amonia merupakan basa lemah. Sebagai perbandingan, basa kuat seperti natrium hidroksida (NaOH) dan kalium hidroksida (KOH) memiliki nilai pKb yang jauh lebih kecil, mendekati nol. Ini berarti NaOH dan KOH terionisasi hampir sempurna dalam larutan, melepaskan ion hidroksida (OH-) dalam jumlah besar. Sebaliknya, amonia hanya terionisasi sebagian, menghasilkan konsentrasi ion hidroksida yang jauh lebih rendah pada konsentrasi yang sama. Perbedaan inilah yang membedakan basa lemah dan basa kuat.
Perbandingan Kekuatan Basa NH3, NaOH, dan KOH
Amonia (NH3), dengan pKb sekitar 4,75, jauh lebih lemah dibandingkan basa kuat seperti NaOH dan KOH yang memiliki pKb mendekati 0. NaOH dan KOH terionisasi sempurna dalam air, melepaskan ion OH- secara signifikan lebih banyak daripada NH3 pada konsentrasi yang sama. Perbedaan ini berdampak besar pada pH larutan dan kemampuannya untuk menetralkan asam. Sebagai contoh, larutan NaOH 0,1 M akan memiliki pH yang jauh lebih tinggi daripada larutan NH3 0,1 M. Ini mencerminkan perbedaan signifikan dalam kekuatan basa.
Perhitungan Konsentrasi Ion Hidroksida (OH-) dalam Larutan NH3, Nh3 termasuk asam atau basa
Misalkan kita memiliki larutan NH3 0,1 M. Untuk menghitung konsentrasi ion hidroksida (OH-), kita dapat menggunakan kesetimbangan basa lemah:
NH3 + H2O ⇌ NH4+ + OH-
Dengan menggunakan nilai Kb (tetapan kesetimbangan basa) yang dapat dihitung dari pKb (Kb = 10-pKb), kita dapat menyelesaikan persamaan kesetimbangan untuk mencari konsentrasi OH-. Perhitungan ini melibatkan penyelesaian persamaan kuadrat, yang menghasilkan konsentrasi OH- yang lebih rendah dibandingkan dengan basa kuat pada konsentrasi yang sama, sesuai dengan sifat basa lemah NH3.
Hubungan Konsentrasi NH3 dan pH Larutan
Grafik hubungan antara konsentrasi NH3 dan pH larutan akan menunjukkan kurva yang cenderung datar pada konsentrasi rendah, kemudian meningkat secara bertahap seiring peningkatan konsentrasi NH3. Kurva ini akan mencerminkan sifat basa lemah NH3, di mana peningkatan konsentrasi tidak menghasilkan peningkatan pH yang sebanding dengan basa kuat. Grafik ini akan menunjukkan bahwa meskipun konsentrasi NH3 meningkat, pH larutan tetap relatif rendah dibandingkan dengan larutan basa kuat dengan konsentrasi yang sama. Hal ini disebabkan oleh ionisasi sebagian dari NH3 dalam air.
Penerapan NH3 dalam Kehidupan Sehari-hari: Nh3 Termasuk Asam Atau Basa
Amonia (NH3), senyawa kimia dengan bau menyengat khas, jauh lebih penting daripada sekadar bahan pembersih rumah tangga. Sifat basanya yang kuat menjadikannya pilar penting dalam berbagai industri dan sektor kehidupan, meski penggunaannya juga membawa konsekuensi lingkungan yang perlu dipertimbangkan. Perjalanan amonia dari laboratorium hingga aplikasi massal ini menunjukkan kompleksitas interaksi antara kemajuan teknologi dan dampaknya terhadap ekosistem.
Aplikasi NH3 dalam Industri dan Kehidupan Sehari-hari
Amonia memiliki peran krusial dalam berbagai sektor. Industri pertanian menjadi konsumen terbesar, menggunakannya sebagai bahan baku pembuatan pupuk nitrogen seperti urea. Di sektor industri, amonia berperan sebagai refrigeran dalam sistem pendingin, menguntungkan karena sifatnya yang mudah menguap dan menyerap panas. Selain itu, amonia juga digunakan dalam produksi berbagai bahan kimia, seperti asam nitrat dan berbagai senyawa nitrogen lainnya yang penting dalam berbagai industri. Di rumah tangga, amonia dalam bentuk encer sering digunakan sebagai bahan pembersih karena kemampuannya membersihkan lemak dan kotoran. Namun, perlu diingat bahwa penggunaan amonia harus hati-hati karena sifatnya yang korosif.
Terakhir
Kesimpulannya, NH3 terbukti sebagai basa lemah yang memiliki peran signifikan dalam berbagai aspek kehidupan. Memahami sifat kimianya, khususnya interaksi dengan air dan nilai pKb-nya, sangat penting untuk mengeksplorasi aplikasinya yang luas. Dari pembuatan pupuk yang mendukung ketahanan pangan hingga pertimbangan dampak lingkungannya, amonia menjadi contoh nyata bagaimana pengetahuan kimia dasar dapat memiliki implikasi yang luas dan berdampak pada kehidupan manusia.
Amonia (NH3), sebagaimana diketahui, bersifat basa. Ini karena kemampuannya menerima ion hidrogen (H+), sebuah karakteristik kunci basa menurut teori asam-basa Brønsted-Lowry. Pemahaman konsep dasar ini, seperti bagaimana NH3 bereaksi, mirip dengan prinsip dasar dalam psikologi perilaku. Perhatikan misalnya, contoh penerapan teori behaviorisme yang menjelaskan bagaimana stimulus dan respons membentuk perilaku; proses yang sistematis dan dapat diprediksi, sama seperti reaksi kimia NH3 yang juga mengikuti aturan tertentu.
Kembali ke NH3, sifat basanya ini memiliki implikasi luas dalam berbagai aplikasi, dari industri pupuk hingga proses sintesis kimia.
Amonia (NH₃), sebuah senyawa yang kerap dijumpai dalam kehidupan sehari-hari, bersifat basa. Sifat basanya ini terkait dengan kemampuannya menerima proton. Nah, menentukan sifat basa amonia ini mirip dengan mempersiapkan wawancara yang efektif; sebelumnya, seperti yang dijelaskan di sebelum melakukan wawancara pewawancara harus menyusun daftar pertanyaan yang terstruktur, kita perlu memahami karakteristik subjek yang akan diwawancarai.
Begitu pula dengan NH₃, pemahaman mendalam terhadap sifat kimianya, khususnya kemampuannya menerima proton, penting untuk menentukan perilakunya dalam reaksi kimia. Kesimpulannya, NH₃ jelas-jelas termasuk senyawa basa.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya