Sifat Khas Atom Karbon: Keunikan atom karbon sebagai tulang punggung kehidupan di Bumi sungguh menakjubkan. Kemampuannya membentuk ikatan yang beragam, membangun rantai panjang dan kompleks, serta menghasilkan keanekaragaman senyawa organik yang luar biasa, membuatnya menjadi pusat perhatian dalam kimia organik. Atom karbon, elemen sederhana ini, menciptakan kompleksitas molekul yang mendukung semua bentuk kehidupan yang kita kenal. Dari struktur sederhana hingga makromolekul yang rumit, peran atom karbon tak tergantikan.
Sifat-sifat unik atom karbon inilah yang memungkinkan terciptanya jutaan senyawa organik, membentuk dasar kehidupan dan beragam material di sekitar kita. Kemampuannya membentuk ikatan tunggal, ganda, dan rangkap tiga, serta membentuk rantai karbon lurus, bercabang, dan siklik, menciptakan keragaman struktur dan fungsi molekul. Pemahaman mendalam tentang sifat-sifat atom karbon membuka jalan untuk inovasi di berbagai bidang, dari pengembangan obat-obatan hingga material canggih.
Sifat-Sifat Unik Atom Karbon: Sifat Khas Atom Karbon
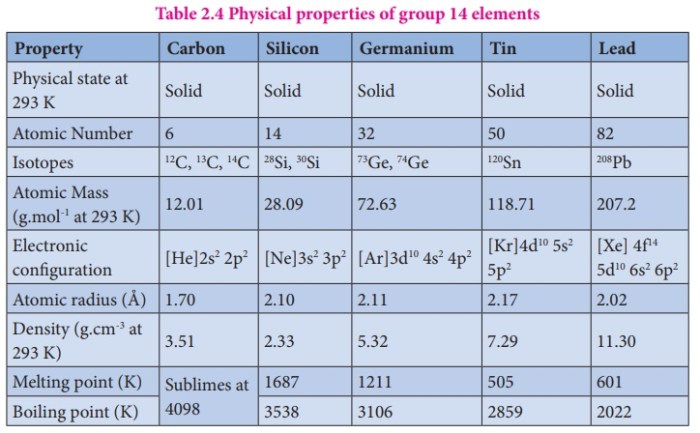
Atom karbon, unsur penyusun kehidupan, memiliki sifat-sifat unik yang memungkinkan pembentukan beragam senyawa organik, membentuk kerangka dasar molekul-molekul kompleks yang kita temukan di alam, mulai dari DNA hingga protein. Keunikan ini terletak pada kemampuannya membentuk ikatan kimia yang beragam dan struktur molekul yang kompleks. Pemahaman mendalam tentang sifat-sifat atom karbon ini menjadi kunci untuk memahami kompleksitas kehidupan dan perkembangan ilmu kimia organik.
Empat Sifat Utama Atom Karbon
Kemampuan atom karbon membentuk berbagai senyawa organik tak lepas dari empat sifat utamanya. Keempat sifat tersebut saling berkaitan dan bekerja sinergis untuk menciptakan keragaman struktur molekul. Sifat-sifat ini membentuk dasar pemahaman kimia organik modern.
- Tetravalensi: Karbon memiliki empat elektron valensi, memungkinkan pembentukan empat ikatan kovalen dengan atom lain. Hal ini memungkinkan terbentuknya rantai karbon panjang dan bercabang, serta struktur siklik.
- Katenasi: Karbon mampu membentuk ikatan kuat dengan atom karbon lain, membentuk rantai dan cincin karbon yang panjang dan kompleks. Inilah yang membedakan karbon dari unsur lain dan memungkinkan terbentuknya berbagai macam senyawa organik.
- Isomerisme: Atom karbon dapat membentuk isomer, yaitu senyawa dengan rumus molekul sama tetapi struktur dan sifat berbeda. Isomerisme merupakan faktor penting dalam keragaman senyawa organik.
- Hibridisasi Orbital: Atom karbon dapat mengalami hibridisasi orbital, membentuk orbital hibrida yang memungkinkan pembentukan ikatan dengan geometri tertentu. Hibridisasi ini berpengaruh pada bentuk dan sifat molekul.
Kemampuan Membentuk Berbagai Jenis Ikatan
Kemampuan atom karbon membentuk ikatan tunggal, ganda, dan rangkap tiga merupakan kunci keragaman senyawa organik. Perbedaan jenis ikatan ini berpengaruh signifikan pada panjang, energi, dan sudut ikatan, serta sifat-sifat kimia senyawa yang dibentuknya.
- Ikatan Tunggal (σ): Contoh: Metana (CH₄). Ikatan tunggal merupakan ikatan kovalen yang kuat dan relatif stabil.
- Ikatan Ganda (σ dan π): Contoh: Etena (C₂H₄). Ikatan ganda terdiri dari satu ikatan sigma (σ) dan satu ikatan pi (π), yang lebih reaktif daripada ikatan tunggal.
- Ikatan Rangkap Tiga (σ dan 2π): Contoh: Etuna (C₂H₂). Ikatan rangkap tiga terdiri dari satu ikatan sigma (σ) dan dua ikatan pi (π), yang merupakan ikatan paling reaktif di antara ketiganya.
Perbandingan Jenis Ikatan Karbon
| Jenis Ikatan | Panjang Ikatan (Å) | Energi Ikatan (kJ/mol) | Sudut Ikatan (°) |
|---|---|---|---|
| Tunggal (C-C) | 1.54 | 348 | 109.5 (tetrahedral) |
| Ganda (C=C) | 1.34 | 614 | 120 (planar) |
| Rangkap Tiga (C≡C) | 1.20 | 839 | 180 (linear) |
Hibridisasi Orbital Atom Karbon
Hibridisasi orbital merupakan proses pencampuran orbital atom untuk membentuk orbital hibrida baru dengan energi dan bentuk yang berbeda. Proses ini memungkinkan karbon membentuk ikatan dengan geometri dan kekuatan yang bervariasi. Ketiga jenis hibridisasi utama atom karbon, sp, sp², dan sp³, menghasilkan geometri molekul yang berbeda.
Kemampuan atom karbon membentuk ikatan kovalen dengan atom karbon lain, membentuk rantai panjang dan struktur kompleks, menjadikannya elemen dasar kehidupan. Sifat unik ini memungkinkan terbentuknya molekul organik yang beragam, dari molekul sederhana hingga biomolekul kompleks. Memahami kerangka dasar ini penting, layaknya memahami peran pengertian guru wilangan dalam sistem pendidikan; keduanya memiliki struktur dasar yang menentukan fungsi dan kompleksitas sistem yang lebih besar.
Kembali ke atom karbon, kemampuannya membentuk ikatan rangkap dan cabang-cabang menciptakan keragaman struktur yang luar biasa, mendukung keberagaman kehidupan di bumi.
- Hibridisasi sp³: Empat orbital hibrida sp³ terbentuk dari satu orbital s dan tiga orbital p. Contoh: Metana (CH₄), dengan geometri tetrahedral dan sudut ikatan 109.5°.
- Hibridisasi sp²: Tiga orbital hibrida sp² terbentuk dari satu orbital s dan dua orbital p. Satu orbital p tetap tidak terhibridisasi. Contoh: Etena (C₂H₄), dengan geometri planar trigonal dan sudut ikatan 120°.
- Hibridisasi sp: Dua orbital hibrida sp terbentuk dari satu orbital s dan satu orbital p. Dua orbital p tetap tidak terhibridisasi. Contoh: Etuna (C₂H₂), dengan geometri linear dan sudut ikatan 180°.
Struktur Lewis dan Tipe Hibridisasi
Struktur Lewis memberikan gambaran visual tentang bagaimana atom-atom terikat dalam suatu molekul, termasuk jumlah elektron valensi dan ikatan yang terbentuk. Dengan mengamati struktur Lewis, kita dapat menentukan tipe hibridisasi karbon dalam molekul tersebut.
- Metana (CH₄): Struktur Lewis menunjukkan empat ikatan tunggal C-H. Karbon mengalami hibridisasi sp³.
- Etena (C₂H₄): Struktur Lewis menunjukkan satu ikatan ganda C=C dan empat ikatan tunggal C-H. Karbon mengalami hibridisasi sp².
- Etuna (C₂H₂): Struktur Lewis menunjukkan satu ikatan rangkap tiga C≡C dan dua ikatan tunggal C-H. Karbon mengalami hibridisasi sp.
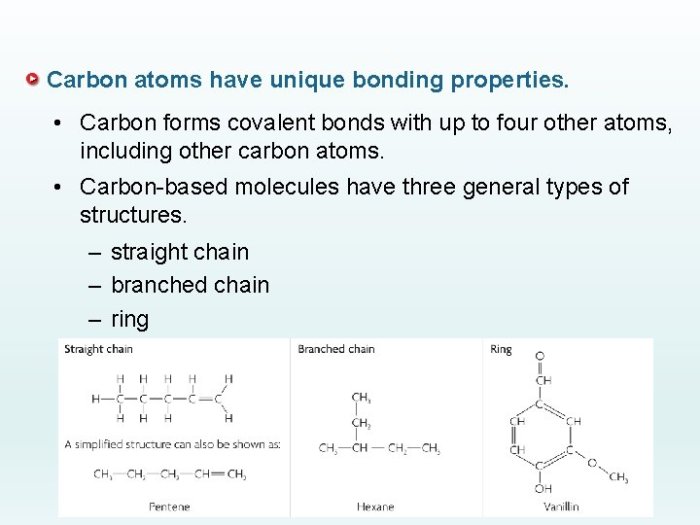
Kemampuan Pembentukan Rantai Karbon
Atom karbon, pilar kehidupan, memiliki kemampuan unik yang membedakannya dari unsur lain: membentuk rantai karbon yang panjang dan kompleks. Kemampuan ini menjadi kunci keberagaman senyawa organik yang melimpah di alam, dari molekul sederhana hingga biomolekul kompleks seperti DNA dan protein. Sifat ikatan karbon yang kuat dan fleksibel memungkinkan terbentuknya rantai lurus, bercabang, dan siklik, menciptakan keragaman struktur dan fungsi yang luar biasa. Mari kita telusuri lebih dalam kemampuan luar biasa atom karbon ini.
Rantai Karbon Lurus, Bercabang, dan Siklik
Kemampuan atom karbon membentuk ikatan kovalen tunggal, ganda, dan rangkap tiga dengan atom karbon lain memungkinkan terbentuknya rantai karbon dengan berbagai konfigurasi. Rantai karbon lurus merupakan rantai karbon yang tidak bercabang, setiap atom karbon terikat pada paling banyak dua atom karbon lain. Rantai bercabang memiliki satu atau lebih atom karbon yang terikat pada lebih dari dua atom karbon lain, menciptakan percabangan pada rantai utama. Sementara itu, rantai siklik membentuk struktur cincin tertutup. Perbedaan struktur ini berdampak signifikan pada sifat fisik dan kimia senyawa organik.
Contoh Senyawa Organik dengan Berbagai Jenis Rantai Karbon
- Rantai Karbon Lurus: Butana (C4H10). Struktur molekulnya berupa empat atom karbon yang terikat secara linear, dengan atom hidrogen terikat pada setiap atom karbon. Senyawa ini merupakan alkana sederhana dengan sifat yang relatif inert.
- Rantai Karbon Bercabang: Isobutana (C4H10). Isomer dari butana, isobutana memiliki satu atom karbon cabang pada rantai utamanya. Meskipun memiliki rumus molekul yang sama dengan butana, sifat fisiknya, seperti titik didih, berbeda.
- Rantai Karbon Siklik: Sikloheksana (C6H12). Enam atom karbon membentuk struktur cincin heksagonal, dengan masing-masing atom karbon terikat pada dua atom karbon lain dan dua atom hidrogen. Sikloheksana merupakan sikloalkana sederhana dengan sifat yang berbeda dibandingkan dengan alkana rantai lurus dengan jumlah atom karbon yang sama.
Ilustrasi Struktur Molekul Berbagai Jenis Rantai Karbon
Butana (rantai lurus): Bayangkan empat bola (atom karbon) disusun secara berurutan, dan setiap bola kecuali dua di ujungnya terikat pada dua bola lainnya dan dua bola kecil (atom hidrogen). Struktur ini membentuk garis lurus.
Isobutana (rantai bercabang): Tiga bola (atom karbon) tersusun secara linear, dengan satu bola tambahan (atom karbon) terikat pada bola tengah. Setiap bola terikat pada atom hidrogen yang cukup untuk memenuhi valensi karbon (empat ikatan). Ini menciptakan percabangan pada rantai utama.
Sikloheksana (rantai siklik): Bayangkan enam bola (atom karbon) tersusun membentuk cincin segi enam yang teratur. Setiap bola terikat pada dua bola lainnya dan dua bola kecil (atom hidrogen). Struktur ini membentuk cincin tertutup.
Perbandingan Sifat Fisik Senyawa Organik dengan Rantai Karbon Lurus dan Bercabang, Sifat khas atom karbon
Senyawa organik dengan rantai karbon lurus cenderung memiliki titik didih yang lebih tinggi dibandingkan isomernya yang bercabang dengan jumlah atom karbon yang sama. Hal ini dikarenakan gaya antarmolekul (gaya London) yang lebih kuat pada rantai lurus akibat luas permukaan yang lebih besar dan interaksi yang lebih efektif antara molekul-molekulnya. Isobutana, misalnya, memiliki titik didih yang lebih rendah daripada butana karena bentuknya yang lebih kompak mengurangi luas permukaan dan interaksi antarmolekul.
Pengaruh Panjang Rantai Karbon terhadap Titik Didih Alkana
Pada alkana, titik didih meningkat seiring dengan bertambahnya panjang rantai karbon. Hal ini disebabkan oleh peningkatan gaya London antarmolekul. Semakin panjang rantai karbon, semakin besar luas permukaan molekul dan semakin kuat gaya tarik-menarik antarmolekul, sehingga dibutuhkan energi yang lebih besar untuk mengubahnya menjadi fase gas, yang tercermin dalam titik didih yang lebih tinggi. Sebagai contoh, metana (C1H4) memiliki titik didih yang jauh lebih rendah daripada oktana (C8H18). Ini menunjukkan korelasi positif antara panjang rantai karbon dan titik didih pada alkana.
Isomerisme pada Senyawa Karbon

Atom karbon, dengan kemampuannya membentuk ikatan kovalen dengan empat atom lain, menghasilkan keragaman senyawa organik yang luar biasa. Kemampuan ini, dikombinasikan dengan sifat-sifat unik karbon, mengarah pada fenomena menarik yang disebut isomerisme. Isomerisme merupakan keberadaan dua atau lebih senyawa yang memiliki rumus molekul sama namun berbeda dalam struktur dan/atau susunan atom-atomnya, mengakibatkan perbedaan sifat kimia dan fisika. Memahami isomerisme krusial dalam kimia organik, karena hal ini memengaruhi sifat dan fungsi berbagai molekul, dari bahan bakar hingga obat-obatan.
Kemampuan atom karbon membentuk ikatan kovalen dengan atom karbon lain, membentuk rantai panjang dan struktur kompleks, menjadikannya dasar kehidupan. Sifat unik ini memungkinkan terciptanya molekul organik yang beragam, sebagaimana kehidupan Nabi Zulkifli yang penuh teladan, yang dapat kita pelajari lebih lanjut melalui artikel ini: apa yang dapat diteladani dari nabi zulkifli. Keteladanan beliau, seperti keuletan dan kesabaran, selayaknya menginspirasi kita untuk menjelajahi kompleksitas alam, termasuk memahami lebih dalam tentang struktur dan fungsi molekul-molekul berbasis karbon yang menakjubkan.
Isomer Struktur dan Isomer Ruang
Isomerisme terbagi menjadi dua kategori utama: isomer struktur dan isomer ruang. Isomer struktur memiliki atom-atom yang terhubung dalam urutan yang berbeda, sedangkan isomer ruang memiliki atom-atom yang terhubung dalam urutan yang sama, tetapi berbeda dalam susunan spasialnya. Perbedaan susunan atom ini berdampak signifikan terhadap sifat-sifat senyawa yang dihasilkan. Mempelajari perbedaan keduanya memberikan pemahaman mendalam mengenai hubungan struktur dan sifat dalam senyawa karbon.
Kemampuan atom karbon membentuk ikatan kovalen yang kuat dan beragam, menjadikannya fondasi kehidupan. Sifat inilah yang memungkinkan terbentuknya molekul kompleks, seperti karbohidrat yang berperan dalam proses kondensasi udara. Proses kondensasi ini, yang menentukan kapan terjadinya embun , bergantung pada suhu dan kelembaban. Kembali pada atom karbon, fleksibilitas ikatannya memungkinkan pembentukan struktur beraneka ragam, dari molekul sederhana hingga makromolekul kompleks yang mendukung berbagai proses biologis, termasuk pembentukan embun itu sendiri.
Contoh Isomer Struktur
Isomer struktur dibagi lagi menjadi tiga jenis: isomer posisi, isomer gugus fungsi, dan isomer rangka. Perbedaannya terletak pada letak gugus fungsi, jenis gugus fungsi, dan kerangka karbonnya. Masing-masing jenis isomer struktur memiliki karakteristik unik yang memengaruhi sifat kimia dan fisika senyawa. Variasi ini memicu eksplorasi yang luas dalam pengembangan material dan senyawa baru dengan fungsi spesifik.
- Isomer Posisi: Contohnya adalah 1-propanol dan 2-propanol. Keduanya memiliki rumus molekul C3H8O, tetapi gugus hidroksil (-OH) berada pada posisi karbon yang berbeda.
- Isomer Gugus Fungsi: Contohnya adalah propanal (aldehida) dan propanon (keton), keduanya memiliki rumus molekul C3H6O, tetapi berbeda dalam gugus fungsinya.
- Isomer Rangka: Contohnya adalah butana dan metilpropana (isobutana). Keduanya memiliki rumus molekul C4H10, tetapi berbeda dalam kerangka karbonnya; butana memiliki rantai karbon lurus, sedangkan metilpropana memiliki rantai karbon bercabang.
Contoh Isomer Ruang
Isomer ruang terjadi ketika atom-atom dalam molekul terhubung dengan urutan yang sama, tetapi memiliki orientasi spasial yang berbeda. Dua jenis utama isomer ruang adalah isomer geometri (cis-trans) dan isomer optik (enantiomer). Perbedaan orientasi ini menghasilkan perbedaan sifat, seperti titik didih, titik leleh, dan aktivitas optik.
- Isomer Geometri (cis-trans): Contohnya adalah asam maleat (cis) dan asam fumarat (trans). Keduanya memiliki rumus molekul C4H4O4, tetapi berbeda dalam posisi gugus karboksil (-COOH) terhadap ikatan rangkap C=C.
- Isomer Optik (enantiomer): Contohnya adalah asam laktat. Asam laktat memiliki dua enantiomer, yang merupakan bayangan cermin satu sama lain dan tidak dapat ditumpangkan. Enantiomer ini memiliki sifat fisik yang identik, tetapi sifat biologisnya dapat sangat berbeda.
Perbandingan Isomer Struktur dan Isomer Ruang
| Jenis Isomer | Perbedaan Struktur | Contoh | Sifat |
|---|---|---|---|
| Isomer Struktur | Urutan ikatan atom berbeda | 1-butena dan 2-butena | Sifat fisik dan kimia berbeda |
| Isomer Ruang | Orientasi spasial atom berbeda | Cis-2-butena dan Trans-2-butena | Sifat fisik sedikit berbeda, sifat kimia dapat berbeda signifikan |
Perbedaan Isomer Geometri Cis dan Trans
Isomer geometri cis dan trans dibedakan oleh posisi relatif gugus-gugus substituen pada ikatan rangkap. Pada isomer cis, gugus-gugus substituen berada di sisi yang sama dari ikatan rangkap, sedangkan pada isomer trans, gugus-gugus substituen berada di sisi yang berlawanan. Perbedaan posisi ini mempengaruhi polaritas molekul dan interaksi antarmolekul, sehingga mengakibatkan perbedaan sifat fisik seperti titik leleh dan titik didih.
Keberadaan Karbon dalam Makromolekul
Atom karbon, pilar kehidupan, memiliki peran sentral dalam membentuk kerangka dasar makromolekul yang esensial bagi semua makhluk hidup. Keunikan atom karbon terletak pada kemampuannya membentuk empat ikatan kovalen yang kuat dan stabil dengan berbagai atom, termasuk karbon lain, hidrogen, oksigen, nitrogen, dan sulfur. Sifat inilah yang memungkinkan terbentuknya struktur kompleks dan beragam makromolekul yang menopang fungsi kehidupan. Keberadaan karbon dalam makromolekul merupakan kunci keberhasilan evolusi kehidupan di bumi.
Makromolekul organik, seperti karbohidrat, protein, dan lipid, merupakan polimer yang tersusun dari monomer-monomer yang saling terikat. Atom karbon bertindak sebagai penghubung utama dalam rantai panjang ini, membentuk tulang punggung struktur makromolekul tersebut. Variasi dalam susunan dan jenis ikatan atom karbon dengan atom lain inilah yang menentukan sifat dan fungsi beragam makromolekul.
Peran Atom Karbon dalam Pembentukan Karbohidrat
Karbohidrat, sumber energi utama bagi makhluk hidup, tersusun dari monomer monosakarida seperti glukosa, fruktosa, dan galaktosa. Atom karbon membentuk rantai karbon yang menjadi kerangka dasar monosakarida. Gugus hidroksil (-OH) yang terikat pada atom karbon menentukan jenis dan sifat monosakarida. Ikatan glikosidik, yang terbentuk antara dua monosakarida melalui reaksi dehidrasi, melibatkan atom karbon dan membentuk disakarida (seperti sukrosa) atau polisakarida (seperti pati dan selulosa). Selulosa, misalnya, merupakan polisakarida yang membentuk dinding sel tumbuhan, dengan rantai panjang glukosa yang saling terikat melalui ikatan β-1,4-glikosidik yang dimediasi oleh atom karbon. Struktur ini memberikan kekuatan dan kekakuan pada dinding sel.
Peran Atom Karbon dalam Pembentukan Protein
Protein, makromolekul yang berperan vital dalam berbagai fungsi seluler, tersusun dari monomer asam amino. Atom karbon α (karbon pusat) dalam setiap asam amino terikat pada gugus amino (-NH2), gugus karboksil (-COOH), atom hidrogen, dan gugus R (rantai samping) yang bervariasi. Ikatan peptida, yang menghubungkan asam amino satu sama lain, terbentuk antara gugus karboksil satu asam amino dan gugus amino asam amino lainnya, dengan atom karbon α sebagai pusat reaksi. Urutan asam amino yang spesifik menentukan struktur primer protein, yang selanjutnya melipat membentuk struktur sekunder, tersier, dan kuartener. Struktur tiga dimensi protein ini sangat penting bagi fungsinya, misalnya enzim, hormon, dan antibodi.
Peran Atom Karbon dalam Pembentukan Lipid
Lipid, makromolekul hidrofobik yang berfungsi sebagai penyimpan energi, komponen membran sel, dan hormon, memiliki struktur yang beragam. Namun, atom karbon tetap berperan penting dalam membentuk kerangka dasar lipid. Asam lemak, misalnya, tersusun dari rantai hidrokarbon panjang dengan atom karbon sebagai tulang punggung. Ikatan ester menghubungkan asam lemak dengan gliserol untuk membentuk trigliserida, sebuah jenis lipid penyimpan energi. Fosfolipid, komponen utama membran sel, memiliki dua asam lemak yang terikat pada gliserol, bersama dengan gugus fosfat dan molekul polar lainnya. Atom karbon dalam rantai hidrokarbon asam lemak menentukan sifat hidrofobik lipid, sementara gugus polar menentukan interaksi lipid dengan air.
Perbedaan Struktur dan Fungsi Ketiga Makromolekul
| Makromolekul | Monomer | Ikatan Utama | Fungsi Utama |
|---|---|---|---|
| Karbohidrat | Monosakarida (glukosa, fruktosa) | Glikosidik | Sumber energi, struktur |
| Protein | Asam amino | Peptida | Enzim, struktur, transport |
| Lipid | Asam lemak, gliserol | Ester | Penyimpan energi, struktur membran |
Atom karbon merupakan elemen kunci dalam kehidupan. Kemampuannya membentuk ikatan kovalen yang beragam dan stabil memungkinkan terbentuknya makromolekul kompleks yang beragam dan esensial bagi fungsi seluler dan kehidupan organisme. Tanpa atom karbon, kehidupan seperti yang kita kenal tidak akan mungkin ada.
Keanekaragaman Senyawa Organik Berbasis Karbon
Atom karbon, dengan kemampuan uniknya membentuk ikatan kovalen dengan atom karbon lain dan berbagai unsur lainnya, menjadi fondasi kehidupan dan beragam material sintetis. Kemampuan ini menghasilkan keanekaragaman senyawa organik yang luar biasa, menciptakan dunia molekul dengan fungsi dan sifat yang sangat beragam. Dari bahan bakar hingga obat-obatan, keberadaan senyawa karbon begitu mendominasi kehidupan modern.
Berbagai Jenis Senyawa Organik
Kemampuan atom karbon membentuk rantai panjang, rantai bercabang, dan struktur cincin, dipadukan dengan berbagai gugus fungsi, menghasilkan beragam jenis senyawa organik. Perbedaan gugus fungsi inilah yang menentukan sifat kimia dan aplikasi senyawa tersebut. Berikut beberapa contohnya:
- Alkana: Hidrokarbon jenuh dengan ikatan tunggal C-C. Contoh: Metana (CH4), digunakan sebagai bahan bakar. Etan (C2H6), komponen gas alam.
- Alkena: Hidrokarbon tak jenuh dengan ikatan rangkap dua C=C. Contoh: Etena (C2H4), digunakan dalam pembuatan plastik polietilena. Propena (C3H6), bahan baku pembuatan polipropilena.
- Alkuna: Hidrokarbon tak jenuh dengan ikatan rangkap tiga C≡C. Contoh: Etuna (C2H2), atau asetilena, digunakan dalam pengelasan.
- Alkohol: Mengandung gugus hidroksil (-OH). Contoh: Etanol (C2H5OH), alkohol dalam minuman beralkohol dan bahan bakar. Metanol (CH3OH), pelarut.
- Aldehida: Mengandung gugus karbonil (-CHO). Contoh: Metanal (HCHO), formaldehida, digunakan sebagai pengawet. Etanal (CH3CHO), asetaldehida, antara lain digunakan dalam produksi asam asetat.
- Keton: Mengandung gugus karbonil (-CO-) di antara dua gugus alkil. Contoh: Propanon (CH3COCH3), atau aseton, pelarut umum.
- Asam Karboksilat: Mengandung gugus karboksil (-COOH). Contoh: Asam etanoat (CH3COOH), atau asam asetat, komponen cuka. Asam benzoat (C6H5COOH), pengawet makanan.
- Ester: Terbentuk dari reaksi antara asam karboksilat dan alkohol. Contoh: Etil asetat (CH3COOCH2CH3), pelarut dan aroma buah-buahan.
Tabel Ringkasan Senyawa Organik
Tabel berikut merangkum rumus umum, gugus fungsi, dan contoh senyawa organik yang telah dijelaskan di atas. Perbedaan gugus fungsi secara signifikan mempengaruhi sifat kimia dan reaktivitas senyawa.
| Jenis Senyawa | Rumus Umum | Gugus Fungsi | Contoh dan Kegunaan |
|---|---|---|---|
| Alkana | CnH2n+2 | – | Metana (CH4) – Bahan bakar |
| Alkena | CnH2n | C=C | Etena (C2H4) – Pembuatan plastik |
| Alkuna | CnH2n-2 | C≡C | Etuna (C2H2) – Pengelasan |
| Alkohol | R-OH | -OH | Etanol (C2H5OH) – Minuman beralkohol |
| Aldehida | R-CHO | -CHO | Metanal (HCHO) – Pengawet |
| Keton | R-CO-R’ | -CO- | Propanon (CH3COCH3) – Pelarut |
| Asam Karboksilat | R-COOH | -COOH | Asam etanoat (CH3COOH) – Cuka |
| Ester | R-COO-R’ | -COO- | Etil asetat (CH3COOCH2CH3) – Aroma buah |
Pengaruh Gugus Fungsi terhadap Sifat Kimia
Gugus fungsi merupakan bagian dari molekul organik yang menentukan reaktivitasnya. Kehadiran gugus hidroksil (-OH) pada alkohol, misalnya, memberikan sifat polar dan kemampuan membentuk ikatan hidrogen, yang memengaruhi titik didih dan kelarutannya. Sebaliknya, alkana yang nonpolar memiliki titik didih rendah dan tidak larut dalam air. Perbedaan gugus fungsi ini menghasilkan beragam sifat kimia yang memungkinkan pemanfaatan senyawa organik dalam berbagai aplikasi.
Hubungan Antar Senyawa Organik
Berbagai senyawa organik seringkali saling berkaitan melalui reaksi kimia. Misalnya, oksidasi alkohol dapat menghasilkan aldehida atau keton, sedangkan oksidasi aldehida dapat menghasilkan asam karboksilat. Reaksi esterifikasi menghasilkan ester dari asam karboksilat dan alkohol. Pemahaman hubungan ini penting dalam sintesis senyawa organik.
Penutup
Kesimpulannya, sifat khas atom karbon merupakan kunci utama keberagaman senyawa organik dan kompleksitas kehidupan. Kemampuannya membentuk ikatan kovalen yang kuat dan beragam, membentuk rantai karbon, serta mengalami isomerisme, menghasilkan jutaan senyawa dengan fungsi yang berbeda-beda. Pemahaman mendalam tentang sifat-sifat ini membuka peluang besar bagi pengembangan teknologi dan inovasi di masa depan. Dari pengembangan material baru hingga penemuan obat-obatan revolusioner, sifat atom karbon terus menginspirasi dan mendorong penemuan-penemuan ilmiah yang luar biasa.
 TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya
TendikPedia Informasi Mengenai Pendidikan yang Akurat dan Terpercaya